题目内容
硅单质及其化合物应用范围很广.请回答下列问题:
制备硅半导体材料必须先得到高纯硅.三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如图所示:
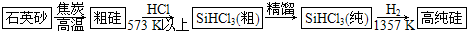
(1)写出由纯SiHCl3制备高纯硅的化学反应方程式: .
(2)整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式: ;
H2还原SiHCl3过程中若混入O2,可能引起的后果是 .
制备硅半导体材料必须先得到高纯硅.三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如图所示:
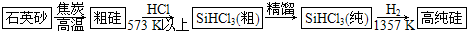
(1)写出由纯SiHCl3制备高纯硅的化学反应方程式:
(2)整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:
H2还原SiHCl3过程中若混入O2,可能引起的后果是
考点:硅和二氧化硅
专题:碳族元素
分析:(1)根据给定的反应物和生成物写出化学方程式,注意反应条件和配平;
(2)写出反应物和给出的生成物H2SiO3和HCl,用原子守恒法找出另一种生成物为H2,并配平.
(2)写出反应物和给出的生成物H2SiO3和HCl,用原子守恒法找出另一种生成物为H2,并配平.
解答:
解:(1)氢气和纯SiHCl3反应生成高纯硅和氯化氢:SiHCl3+H2
Si+3HCl,故答案为:SiHCl3+H2
Si+3HCl;
(2)SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:3SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑,氢气遇氧气易爆炸,故答案为:SiHCl3+3H2O═H2SiO3↓+3HCl↑+H2↑;氧气与氢气混合,可能引起爆炸.
| ||
| ||
(2)SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:3SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑,氢气遇氧气易爆炸,故答案为:SiHCl3+3H2O═H2SiO3↓+3HCl↑+H2↑;氧气与氢气混合,可能引起爆炸.
点评:本题考查硅和二氧化硅的性质,题目难度中等,注意双水解时,可生成沉淀和气体.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
甲基带有的电荷数是( )
| A、-3 | B、0 | C、+1 | D、+3 |
取16.8g碳酸氢钠固体加热一段时间后,剩余固体质量13.7g,把剩余固体加入到100mL 2mol/L的稀硫酸中,充分反应后溶液中氢离子的浓度约为( )
| A、1.4mol?L-1 |
| B、3mol?L-1 |
| C、0.5mol?L-1 |
| D、2mol?L-1 |
现有容积相同的①和②两个密闭容器,向①中加入2molHI,向②中加入1molHI,在150℃时发生反应:2HI(g)?H2(g)+I2(g),一段时间后二者都达到了平衡状态,下列说法正确的是( )
| A、平衡时I2蒸气的浓度:①>② |
| B、平衡时I2蒸气在混合气体中的物质的量分数:①>② |
| C、平衡时HI的分解率:①=② |
| D、从反应开始到达平衡,所需时间:①>② |
 A、T、X、Y、Z是中学化学常见的四种元素,原子序数依次增大,其结构或性质信息如下表:
A、T、X、Y、Z是中学化学常见的四种元素,原子序数依次增大,其结构或性质信息如下表:

 (1)已知:常压下,氨气在300℃时约有9.7%分解,水蒸气在2000℃时约有4%分解,氟化氢气体在3000℃时仍不分解.则这三种物质的稳定性由强到弱的顺序是
(1)已知:常压下,氨气在300℃时约有9.7%分解,水蒸气在2000℃时约有4%分解,氟化氢气体在3000℃时仍不分解.则这三种物质的稳定性由强到弱的顺序是