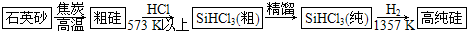题目内容
取16.8g碳酸氢钠固体加热一段时间后,剩余固体质量13.7g,把剩余固体加入到100mL 2mol/L的稀硫酸中,充分反应后溶液中氢离子的浓度约为( )
| A、1.4mol?L-1 |
| B、3mol?L-1 |
| C、0.5mol?L-1 |
| D、2mol?L-1 |
考点:化学方程式的有关计算
专题:计算题
分析:发生2NaHCO3
Na2CO3+CO2↑+H2O,加热一段时间后,剩余固体质量13.7g,利用差量法确定固体的成分,加盐酸发生HCO3-+H+=H2O+CO2↑、CO32-+2H+=H2O+CO2↑,以此计算反应后溶液中氢离子的浓度.
| ||
解答:
解:16.8g碳酸氢钠固体,加热一段时间后,剩余固体的质量为13.7g,n(NaHCO3)=
=0.2mol,则
2NaHCO3
Na2CO3+CO2↑+H2O△m
2 1 62g
0.1mol 0.05mol 16.8g-13.7g=3.1g
即反应后固体中含NaHCO3 物质的量为0.2mol-0.1mol=0.1mol、Na2CO3物质的量为0.05mol;
100mL 2mol/L的稀硫酸中n(H+)=0.1L×2mol/L×2=0.4mol,由
HCO3-+H+=H2O+CO2↑;
1 1
0.1mol 0.1mol
CO32-+2H+=H2O+CO2↑,
1 2
0.05mol 0.1mol
所以溶液中剩余氢离子物质的量为0.4mol-0.1mol-0.1mol=0.2mol,
充分反应后溶液中氢离子的浓度约为
=2mol/L,
故选D.
| 16.8g |
| 84g/mol |
2NaHCO3
| ||
2 1 62g
0.1mol 0.05mol 16.8g-13.7g=3.1g
即反应后固体中含NaHCO3 物质的量为0.2mol-0.1mol=0.1mol、Na2CO3物质的量为0.05mol;
100mL 2mol/L的稀硫酸中n(H+)=0.1L×2mol/L×2=0.4mol,由
HCO3-+H+=H2O+CO2↑;
1 1
0.1mol 0.1mol
CO32-+2H+=H2O+CO2↑,
1 2
0.05mol 0.1mol
所以溶液中剩余氢离子物质的量为0.4mol-0.1mol-0.1mol=0.2mol,
充分反应后溶液中氢离子的浓度约为
| 0.2mol |
| 0.1L |
故选D.
点评:本题考查化学反应方程式的计算,为高频考点,把握差量法计算固体的成分及发生的反应为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
下列物质中都含有氢元素,按照已学知识判断其中属于酸的是( )
| A、NH3 |
| B、CH4 |
| C、NaHCO3 |
| D、HClO3 |
下列有关化学实验叙述正确的是( )
| A、容量瓶、滴定管、分液漏斗使用前都必须检查是否漏水 |
| B、用98%的浓硫酸配制100g10%的稀硫酸时,除使用量筒外还需用到容量瓶 |
| C、在钠跟水反应的实验中,切下绿豆粒大小的钠投入水中进行实验,剩余的钠块丢弃到废料桶中 |
| D、若FeCl2溶液中含有I-杂质,可用过量Cl2氧化后进行萃取分液 |
下列关于电解质、非电解质的说法正确的是( )
| A、氯气溶于水得氯水,该溶液能导电,因此氯气是电解质 |
| B、CaCO3饱和溶液导电能力很弱,故CaCO3是弱电解质 |
| C、导电能力弱的溶液肯定是弱电解质的溶液 |
| D、HF的水溶液中既有H+、F-,又有大量的HF分子,因此HF是弱电解质 |
下列属于油脂的用途的是( )
①人类的营养物质 ②制取肥皂 ③制取甘油 ④制备汽油.
①人类的营养物质 ②制取肥皂 ③制取甘油 ④制备汽油.
| A、①②④ | B、①③⑤ |
| C、②③④⑤ | D、①②③ |
某有机物在氧气中充分燃烧,生成水蒸气和CO2的物质的量之比为1:1,由此可以得出的结论是( )
| A、该有机物分子中C、H、O原子个数比为1:2:3 |
| B、分子中C、H原子个数比为1:2 |
| C、有机物中必定含有氧 |
| D、有机物中一定不含氧 |
下列化学式只能表示一种物质的是( )
| A、C4H8 |
| B、CH2Cl2 |
| C、C2H6O |
| D、C2H4O2 |