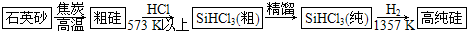题目内容
现有容积相同的①和②两个密闭容器,向①中加入2molHI,向②中加入1molHI,在150℃时发生反应:2HI(g)?H2(g)+I2(g),一段时间后二者都达到了平衡状态,下列说法正确的是( )
| A、平衡时I2蒸气的浓度:①>② |
| B、平衡时I2蒸气在混合气体中的物质的量分数:①>② |
| C、平衡时HI的分解率:①=② |
| D、从反应开始到达平衡,所需时间:①>② |
考点:化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:容器①中反应物浓度大于容器②,但效果只是①中反应速率快,所需时间短,由于①容器中物质浓度大,故①的压强较大,增大压强反应向气体体积减小方向进行.但因为这个反应前后物质计量数之和都是2,所以不存在气体体积减小方向,平衡不移动,即压强对转化率没有影响,当平衡时①②中HI的转化率是相同的.由于①中投料多,所以HI转化为更多的碘,体积相同,所以①容器中碘蒸气浓度更高.
解答:
解:A、①容器中各物质的浓度比②容器中各物质的浓度大,①>②,故A正确;
B、平衡时①、②中HI的转化率相同,设转化率为x,2HI(g)?H2(g)+I2(g),平衡时①容器中:HI物质的量为2-2x,H2和I2均为x;平衡时②容器中:HI物质的量为1-x,H2和I2为
x,物质的量的百分含量为
x,所以是相同的,①=②,故B错误;
C、两容器中平衡时HI的转化率相同,①=②,故C正确;
D、容器中①中反应物的浓度大,反应速率大,达平衡需要的时间少,①<②故D错误;
故选AC.
B、平衡时①、②中HI的转化率相同,设转化率为x,2HI(g)?H2(g)+I2(g),平衡时①容器中:HI物质的量为2-2x,H2和I2均为x;平衡时②容器中:HI物质的量为1-x,H2和I2为
| 1 |
| 2 |
| 1 |
| 2 |
C、两容器中平衡时HI的转化率相同,①=②,故C正确;
D、容器中①中反应物的浓度大,反应速率大,达平衡需要的时间少,①<②故D错误;
故选AC.
点评:本题考查了反应前后气体体积不变的化学反应的等效平衡,在达到平衡时的各量的变化,化学平衡的计算,题目难度中等.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
下列属于油脂的用途的是( )
①人类的营养物质 ②制取肥皂 ③制取甘油 ④制备汽油.
①人类的营养物质 ②制取肥皂 ③制取甘油 ④制备汽油.
| A、①②④ | B、①③⑤ |
| C、②③④⑤ | D、①②③ |
某有机物在氧气中充分燃烧,生成水蒸气和CO2的物质的量之比为1:1,由此可以得出的结论是( )
| A、该有机物分子中C、H、O原子个数比为1:2:3 |
| B、分子中C、H原子个数比为1:2 |
| C、有机物中必定含有氧 |
| D、有机物中一定不含氧 |
下列说法错误的是( )
| A、多电子原子中,在离核较远的区域内运动的电子能量较低 |
| B、元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素 |
| C、除氦以外的稀有气体原子的最外层电子数都是8 |
| D、同周期元素中,除稀有气体外,ⅦA族元素的原子半径较小 |
NA表示阿伏加德罗常数,下列判断正确的是( )
| A、含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol?L-1 |
| B、1L0.1mol?L-1的氨水含有0.1NA个NH3?H2O |
| C、5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等 |
| D、10LpH=1的硫酸溶液中含有的H+离子数为2NA |
下列关于判断过程的方向的说法错误的是( )
| A、NH4NO3溶于水吸热,说明其溶于水不是自发过程 |
| B、同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 |
| C、不借助于外力能自发进行的过程,其体系的能量趋向于从高能状态转变为低能状态 |
| D、由焓判据和熵判据组合而成的复合判据,更适合于所有的过程 |
下列化学式只能表示一种物质的是( )
| A、C4H8 |
| B、CH2Cl2 |
| C、C2H6O |
| D、C2H4O2 |
下列反应的离子方程式不正确的是( )
| A、用盐酸清除水垢CaCO3+2H+=Ca2++CO2↑+H2O |
| B、Fe跟稀硫酸反应:Fe+2H+=Fe2++H2↑ |
| C、Na2O2投入水中 2Na2O2+2H2O=4Na++4OH-+O2↑ |
| D、碳酸氢钠溶液跟氢氧化钠溶液反应 HCO3-+OH-=H2O+CO2↑ |