题目内容
观察如图1所示的部分图形,并按要求回答下列问题

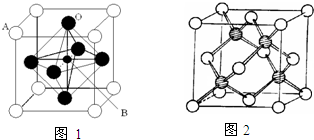
(1)由金刚石晶体结构和晶胞图知,金刚石是原子晶体,晶体中碳原子取
杂化轨道形成σ键,每个晶胞中含碳原子数为 个.
(2)白磷分子(P4)中键角为 ,分子的空间结构为 ,每1mol白磷分子含 mol P-P共价键.若将1分子白磷中所有P-P键打开并各插入一个氧原子所得氧化物的分子式为 ,若每个P原子的孤对电子再与氧原子配位,就可得到磷的另一种氧化物 (填分子式).
(3)由SiO2晶体结构知SiO2晶体是 晶体,每1mol SiO2晶体含 mol Si-O共价键.
(4)已知CaC2晶体的晶胞结构与NaCl晶体相似,(如图2)但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长,则CaC2晶体中Ca2+配位数(C.N)为 .C22-与O22+互为等电子体,O22+的电子式为 ,1molO22+中含π键数目为 .
(5)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体.其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,观察图形回答.这个基本结构单元由 个硼原子组成,共含有 个B-B键.
(6)若测得mg NaCl固体的体积为Vcm3,已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm,则阿佛加德罗常数NA的表达式为 .

(1)由金刚石晶体结构和晶胞图知,金刚石是原子晶体,晶体中碳原子取
杂化轨道形成σ键,每个晶胞中含碳原子数为
(2)白磷分子(P4)中键角为
(3)由SiO2晶体结构知SiO2晶体是
(4)已知CaC2晶体的晶胞结构与NaCl晶体相似,(如图2)但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长,则CaC2晶体中Ca2+配位数(C.N)为
(5)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体.其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,观察图形回答.这个基本结构单元由
(6)若测得mg NaCl固体的体积为Vcm3,已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm,则阿佛加德罗常数NA的表达式为
考点:晶胞的计算,判断简单分子或离子的构型,配合物的成键情况
专题:化学键与晶体结构
分析:(1)在金刚石晶体中C原子周围有4个σ键,所以C的杂化方式为:SP3,根据均摊法算得晶胞中碳原子数目为:8×
+6×
+4=8,据此答题;
(2)在白磷分子(P4)中,P原子在由4个P原子构成的正四面体上,以P-P单键作用,所以键角为60°,分子的空间结构为正四面体,每1mol白磷分子含6mol P-P共价键,若将1分子白磷中所有P-P键打开并各插入一个氧原子(即1分子中可插入6个O原子)所得氧化物的分子式为P4O6,由于每个P原子形成三个共价键,所以每个P原子还有一对孤对电子,若每个P原子的孤对电子再与氧原子配位,就还可再结合4个O原子,所以可得到磷的另一种氧化物P4O10,据此答题;
(3)因为SiO2晶体是由Si原子和O原子通过共价键相互作用而构成的,所以是原子晶体,Si原子最外层有四个电子,可以形成四个Si-O键,所以每1mol SiO2晶体含 4mol Si-O共价键,据此答题;
(4)由CaC2晶体的晶胞结构图可以看出在每个Ca2+周围距离最近的C22-在同一层上的四个,所以Ca2+的配位数是4,因为C22-与O22+互为等电子体,等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键,所以O22+的电子式为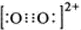 ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,据此答题;
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,据此答题;
(5)根据晶体硼的基本结构单元图可知,基本结构单元中含有20个正三角形,每个顶角各有一个原子,每个顶点被5个正三角形共用,所以基本结构单元中含有硼原子个数为
=12,每个B-B键被两个三角形共用,所以B-B键(即基本结构单元的棱边数)为:
=30;据此答题;
(6)根据NaCl的质量和体积求得密度,再由密度和晶胞的体积计算出一个NaCl晶胞的质量,根据1molNaCl的质量、摩尔质量和阿伏加德罗常数的关系计算阿伏加德罗常数.
| 1 |
| 8 |
| 1 |
| 2 |
(2)在白磷分子(P4)中,P原子在由4个P原子构成的正四面体上,以P-P单键作用,所以键角为60°,分子的空间结构为正四面体,每1mol白磷分子含6mol P-P共价键,若将1分子白磷中所有P-P键打开并各插入一个氧原子(即1分子中可插入6个O原子)所得氧化物的分子式为P4O6,由于每个P原子形成三个共价键,所以每个P原子还有一对孤对电子,若每个P原子的孤对电子再与氧原子配位,就还可再结合4个O原子,所以可得到磷的另一种氧化物P4O10,据此答题;
(3)因为SiO2晶体是由Si原子和O原子通过共价键相互作用而构成的,所以是原子晶体,Si原子最外层有四个电子,可以形成四个Si-O键,所以每1mol SiO2晶体含 4mol Si-O共价键,据此答题;
(4)由CaC2晶体的晶胞结构图可以看出在每个Ca2+周围距离最近的C22-在同一层上的四个,所以Ca2+的配位数是4,因为C22-与O22+互为等电子体,等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键,所以O22+的电子式为
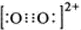 ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,据此答题;
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,据此答题;(5)根据晶体硼的基本结构单元图可知,基本结构单元中含有20个正三角形,每个顶角各有一个原子,每个顶点被5个正三角形共用,所以基本结构单元中含有硼原子个数为
| 20×3 |
| 5 |
| 20×3 |
| 2 |
(6)根据NaCl的质量和体积求得密度,再由密度和晶胞的体积计算出一个NaCl晶胞的质量,根据1molNaCl的质量、摩尔质量和阿伏加德罗常数的关系计算阿伏加德罗常数.
解答:
解:(1)在金刚石晶体中C原子周围有4个σ键,所以C的杂化方式为sp3,根据均摊法算得晶胞中碳原子数目为:8×
+6×
+4=8,故答案为:sp3;8;
(2)在白磷分子(P4)中,P原子在由4个P原子构成的正四面体上,以P-P单键作用,所以键角为60°,分子的空间结构为正四面体,每1mol白磷分子含6mol P-P共价键,若将1分子白磷中所有P-P键打开并各插入一个氧原子(即1分子中可插入6个O原子)所得氧化物的分子式为P4O6,由于每个P原子形成三个共价键,所以每个P原子还有一对孤对电子,若每个P原子的孤对电子再与氧原子配位,就还可再结合4个O原子,所以可得到磷的另一种氧化物P4O10,
故答案为:60°;正四面体;6;P4O6;P4O10;
(3)因为SiO2晶体是由Si原子和O原子通过共价键相互作用而构成的,所以是原子晶体,Si原子最外层有四个电子,可以形成四个Si-O键,所以每1mol SiO2晶体含 4mol Si-O共价键,故答案为:原子;4;
(4)由CaC2晶体的晶胞结构图可以看出在每个Ca2+周围距离最近的C22-在同一层上的四个,所以Ca2+的配位数是4,因为C22-与O22+互为等电子体,等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键,所以O22+的电子式为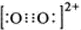 ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,
故答案为:4;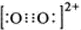 ;2NA个;
;2NA个;
(5)根据晶体硼的基本结构单元图可知,基本结构单元中含有20个正三角形,每个顶角各有一个原子,每个顶点被5个正三角形共用,所以基本结构单元中含有硼原子个数为
=12,每个B-B键被两个三角形共用,所以B-B键(即基本结构单元的棱边数)为:
=30,
故答案为:12;30;
(6)根据NaCl的质量和体积求得NaCl的密度为
g/cm3,NaCl晶胞的体积为(2a)3cm3,
则NaCl晶胞的质量为:
g/cm3×(2a)3cm3=
×(2a)3g,一个NaCl晶胞含4个“NaCl”,
而每个“NaCl”的质量为
,根据
×(2a)3=4×
,得NA=
=
,
故答案为:
.
| 1 |
| 8 |
| 1 |
| 2 |
(2)在白磷分子(P4)中,P原子在由4个P原子构成的正四面体上,以P-P单键作用,所以键角为60°,分子的空间结构为正四面体,每1mol白磷分子含6mol P-P共价键,若将1分子白磷中所有P-P键打开并各插入一个氧原子(即1分子中可插入6个O原子)所得氧化物的分子式为P4O6,由于每个P原子形成三个共价键,所以每个P原子还有一对孤对电子,若每个P原子的孤对电子再与氧原子配位,就还可再结合4个O原子,所以可得到磷的另一种氧化物P4O10,
故答案为:60°;正四面体;6;P4O6;P4O10;
(3)因为SiO2晶体是由Si原子和O原子通过共价键相互作用而构成的,所以是原子晶体,Si原子最外层有四个电子,可以形成四个Si-O键,所以每1mol SiO2晶体含 4mol Si-O共价键,故答案为:原子;4;
(4)由CaC2晶体的晶胞结构图可以看出在每个Ca2+周围距离最近的C22-在同一层上的四个,所以Ca2+的配位数是4,因为C22-与O22+互为等电子体,等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键,所以O22+的电子式为
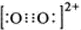 ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,故答案为:4;
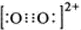 ;2NA个;
;2NA个;(5)根据晶体硼的基本结构单元图可知,基本结构单元中含有20个正三角形,每个顶角各有一个原子,每个顶点被5个正三角形共用,所以基本结构单元中含有硼原子个数为
| 20×3 |
| 5 |
| 20×3 |
| 2 |
故答案为:12;30;
(6)根据NaCl的质量和体积求得NaCl的密度为
| m |
| V |
则NaCl晶胞的质量为:
| m |
| V |
| m |
| V |
而每个“NaCl”的质量为
| M(NaCl) |
| NA |
| m |
| V |
| 58.5 |
| NA |
| 4×58.5×V |
| m×(2a)3 |
| 58.5×V |
| 2ma3 |
故答案为:
| 58.5×V |
| 2ma3 |
点评:本题主要考查了晶胞的计算、简单离子分子的构型、晶体的结构等知识,中等难度,解题关键要熟练掌握基础知识的灵活运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
若某个碳原子边连接着四个不同的原子或原子团,这种碳原子称“手性碳原子”,凡有一个手性碳原子的物质一定具有光学活性.在下列有机物中,具有光学活性的是( )
| A、CH3CH2CH3 |
| B、CH2=CHCH=CH2 |
| C、CH3CH2CH2OH |
D、 |
下列有关化学实验叙述正确的是( )
| A、容量瓶、滴定管、分液漏斗使用前都必须检查是否漏水 |
| B、用98%的浓硫酸配制100g10%的稀硫酸时,除使用量筒外还需用到容量瓶 |
| C、在钠跟水反应的实验中,切下绿豆粒大小的钠投入水中进行实验,剩余的钠块丢弃到废料桶中 |
| D、若FeCl2溶液中含有I-杂质,可用过量Cl2氧化后进行萃取分液 |
下列说法错误的是( )
| A、多电子原子中,在离核较远的区域内运动的电子能量较低 |
| B、元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素 |
| C、除氦以外的稀有气体原子的最外层电子数都是8 |
| D、同周期元素中,除稀有气体外,ⅦA族元素的原子半径较小 |
 过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题: 某实验需要用1.0mol?L-1 NaOH 溶液500mL.
某实验需要用1.0mol?L-1 NaOH 溶液500mL.