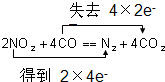题目内容
15.下列溶液中通入SO2后,最终一定会出现沉淀的是( )| A. | HCl和Ba(NO3)2的混合溶液 | B. | BaCl2溶液 | ||
| C. | NaOH溶液 | D. | 澄清石灰水 |
分析 A.硝酸根离子在酸性环境下能够氧化二氧化硫生成硫酸根离子;
B.盐酸酸性强于亚硫酸,依据强酸制备弱酸规律解答;
C.二氧化硫与氢氧化钠反应生成亚硫酸钠或者亚硫酸氢钠;
D.二氧化硫过量反应生成亚硫酸氢钙.
解答 解:A.HCl和Ba(NO3)2的混合溶液通入二氧化硫反应生成硫酸钡沉淀,故A选;
B.盐酸酸性强于亚硫酸,依据强酸制备弱酸规律可知BaCl2溶液与二氧化硫不反应,故B不选;
C.二氧化硫与氢氧化钠反应生成亚硫酸钠或者亚硫酸氢钠,二者都易溶于水,不会产生沉淀,故C不选;
D.二氧化硫过量反应生成亚硫酸氢钙,亚硫酸氢钙易溶于水,所以二氧化硫过量时不会产生沉淀,故D不选;
故选:A.
点评 本题考查了元素化合物知识,明确二氧化硫的酸性氧化物、还原性、氧化性是解题关键,注意二氧化硫与氢氧化钙反应量对反应产物的影响,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.如图是某学校实验室从化学试剂商店买的98%硫酸试剂标签上的部分内容.据此下列说法正确的是( )


| A. | 该硫酸的物质的量浓度为1.84mol/L | |
| B. | 若 Zn与该硫酸反应消耗13克Zn,一定产生4.48升气体 | |
| C. | 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL | |
| D. | 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L |
6.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 2L 1mol/L Na2SO4溶液中离子总数为3NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 4℃、101.3kPa时,54mL H2O中含有的原子数为3NA | |
| D. | 78g Na2O2与足量水充分反应时电子转移数为NA |
3.下列关于胶体的叙述不正确的是( )
| A. | 胶体和溶液、悬浊液的本质区别是它们分散质粒子的大小 | |
| B. | 光线透过胶体时,胶体发生丁达尔效应 | |
| C. | 布朗运动是胶体粒子特有的运动形式,可以据此把胶体和溶液、悬浊液区别开来 | |
| D. | Fe(OH)3胶体粒子具有较大的表面积,能吸附阳离子,故在电场作用下会定向移动 |
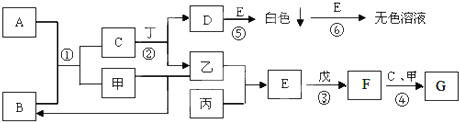
7.有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多两个;在周期表中,C是E的邻族元素,化学性质活泼;D和E位于同一周期,且D和E的原子序数之和为30.
(1)甲的电子式 ,丁的结构式
,丁的结构式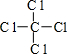
(2)E元素在周期表中的位置是第三周期ⅦA族,其最简单离子的结构示意图为 .
.
(3)五种元素中,既可以与盐酸反应,又可以与氢氧化钠溶液反应的是Al(填元素符号),并写出反应的离子方程式:2Al+6H+=2Al3++3H2↑、2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A:C=1:1 | B:C=1:2 | D:E=1:3 | B:E=1:4 |
(1)甲的电子式
 ,丁的结构式
,丁的结构式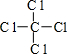
(2)E元素在周期表中的位置是第三周期ⅦA族,其最简单离子的结构示意图为
 .
.(3)五种元素中,既可以与盐酸反应,又可以与氢氧化钠溶液反应的是Al(填元素符号),并写出反应的离子方程式:2Al+6H+=2Al3++3H2↑、2Al+2OH-+2H2O=2AlO2-+3H2↑.
4.从1L1mol/L的氯化钾溶液中取出50mL溶液,该50mL氯化钾溶液的物质的量浓度为( )
| A. | 0.02 mol/L | B. | 0.05 mol/L | C. | 1 mol/L | D. | 2mol/L |