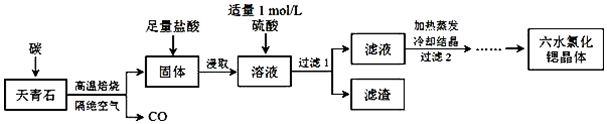
题目内容
16.下列物质中,不与水反应的是( )| A. | Cl2 | B. | Na2O2 | C. | Na2O | D. | NaOH |
分析 A.Cl2和水反应生成HCl和HClO;
B.过氧化钠和水反应生成氢氧化钠和氧气;
C.氧化钠和水反应生成氢氧化钠;
D.NaOH和水不反应.
解答 解:A.Cl2和水反应生成HCl和HClO,方程式为:Cl2+H2O?HCl+HClO,故A不选;
B.过氧化钠和水反应生成氢氧化钠和氧气,方程式为:2Na2O2+2H2O=4NaOH+O2↑,故B不选;
C.氧化钠和水反应生成氢氧化钠,方程式为:Na2O+H2O=NaOH,故C不选;
D.NaOH和水不反应,故D选;
故选D.
点评 本题考查了钠及其化合物的性质,明确物质的性质是解本题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列化合物的电子式书写正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
7.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,56g由N2和CO组成的混合气体含有的原子数目为4 NA | |
| B. | 高温下,0.2 molFe与足量水蒸气反应,生成的H2分子数为0.3NA | |
| C. | 1 L 1.0mol•L-1的NaAlO2水溶液中含有的总原子数为2NA | |
| D. | 1 mol羟基中含有的电子数为10NA |
4.根据下列实验操作,预测的实验现象和实验结论或解释正确的是( )
| 实验操作 | 预测的实验现象 | 实验结论或解释 | |
| A | 向饱和Na2CO3 溶液中滴加少量稀盐酸 | 立即有气体逸出 | CO32-+2H+═H2O+CO2↑ |
| B | 将浓硫酸滴加到盛有铜片的试管中,并将 蘸有品红溶液的试纸置于试管口 | 品红试纸褪色 | SO2具有漂白性 |
| C | 铝箔在酒精灯火焰上加热 | 铝熔化但不会滴下 | A12O3的熔点比铝高 |
| D | 向淀粉的酸性水解液中滴入少量新制 Cu (OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
1.新型锌-空气电池的储存电量是锂电池的三倍,成本是锂电池的一半.这种电池使用特殊材料吸附空气中的氧,电池放电时总反应:2Zn+O2+4OH-+2H2O═2Zn(OH)42-,电解液是KOH溶液.下列有关该电池的说法正确的是( )
| A. | 锌是负极,发生还原反应 | |
| B. | O2在正极发生氧化反应 | |
| C. | 工作一段时间后,电解质溶液的碱性会减弱 | |
| D. | 该电池能将化学能全部转化为电能 |
8.少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①滴入几滴浓盐酸
②加NaCl溶液
③滴入几滴硫酸铜溶液
④升高温度(不考虑盐酸挥发)
⑤改用 18.4mol/L的硫酸溶液.
①滴入几滴浓盐酸
②加NaCl溶液
③滴入几滴硫酸铜溶液
④升高温度(不考虑盐酸挥发)
⑤改用 18.4mol/L的硫酸溶液.
| A. | ①③④ | B. | ②④ | C. | ①④ | D. | ①④⑤ |
10.下列有关实验的叙述正确的是( )
| A. | 将10%的葡萄糖溶液加入新制氢氧化铜悬浊液中,加热可得到砖红色沉淀 | |
| B. | 苯加入到溴水中,苯和溴发生取代反应而使溴水褪色 | |
| C. | 在洁净的试管中加入1~2 mL AgNO3溶液,再滴加稀氨水,直到AgOH完全沉淀,即制得银氨溶液 | |
| D. | 在空气中灼烧铜丝,待铜丝冷却后伸入乙醇中,反复多次,可以制得乙醛 |
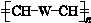 (W是链节中的部分结构)是一类重要的功能高分子材料.聚合物 X是其中的一种,转化路线如图:
(W是链节中的部分结构)是一类重要的功能高分子材料.聚合物 X是其中的一种,转化路线如图: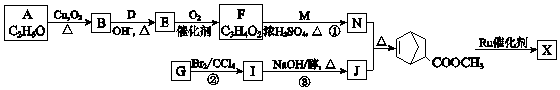
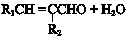
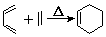
 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$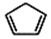 +2 NaBr+2 H2O.
+2 NaBr+2 H2O.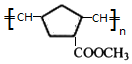 .
.