题目内容
5.锶(Sr)为第五周期IIA族元素,其化合物六水氯化锶(SrCl2•6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如图: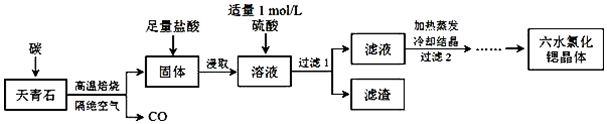
已知:
①经盐酸浸取后的溶液中除含有Sr2+和Cl-外,还有少量的Ba2+杂质.
②BaSO4的溶度积常数为1.1×10-10,SrSO4的溶度积常数为3.3×10-7.
③SrCl2•6H2O的摩尔质量为267g/mol
(1)工业上天青石焙烧前应先研磨粉碎,其目的是增加反应物的接触面积,提高化学反应速率.
(2)工业上天青石隔绝空气高温焙烧时,若0.5mol SrSO4中只有S元素被还原,且转移了4mol电子.则该反应的化学方程式为SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑.
(3)浸取后加入硫酸的目的是(用离子方程式表示)SO42-+Ba2+=BaSO4↓.为了提高原料的利用率,滤液中Sr2+的浓度应不高于0.03 mol/L (注:此时滤液中Ba2+浓度为1×10-5mol/L).
(4)产品纯度检测:称取1.000g产品溶解于适量水中,向其中加入含AgNO30.01mol的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应的离子),待Cl-完全沉淀后,滴入1-2滴含Fe3+的溶液作指示剂,用0.2000mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出.(已知:SCN-先与Ag+反应).
①滴定反应达到终点的现象是当加入最后1滴NH4SCN溶液时,溶液由无色变为血红色,且30s不褪色.
②若滴定过程用去上述浓度的NH4SCN溶液20.00mL,则产品中SrCl2•6H2O的质量百分含量为80.1%(保留3位有效数字).
(5)由SrCl2•6H2O晶体制取无水氯化锶的主要仪器除了酒精灯、泥三角、三脚架外,还有坩埚.
分析 以天青石(主要成分为SrSO4)为原料制备六水氯化锶(SrCl2•6H2O),由流程可知,天青石和碳隔绝空气高温焙烧生成CO、SrS,SrS加盐酸后溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质,然后加硫酸生成硫酸钡沉淀,所以过滤后滤渣为硫酸钡,滤液中含SrSO4、SrCl2,最后蒸发、冷却结晶得到SrCl2•6H2O,据此分析解答.
解答 解:(1)研磨粉碎的目的是增加反应物的接触面积,提高反应速率,提高原料的转化率,;
故答案为:增加反应物的接触面积,提高化学反应速率;
(2)由SrSO4中只有S被还原,且1mol SrSO4反应电子转移8mol,则该反应的化学方程式为SrSO4+4C $\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑;
故答案为:SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑;
(3)在用HCl溶解SrS后的溶液中加入硫酸的目的是除去溶液中Ba2+杂质,反应为:SO42-+Ba2+=BaSO4↓;
由于在Ba2+浓度为1×10-5 mol/L,BaSO4的溶度积常数为1.1×10-10,所以c(SO42-)=$\frac{1.1×1{0}^{-10}}{1×1{0}^{-5}}$mol/L=1.1×10-5mol/L,而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=$\frac{3.3×1{0}^{-7}}{1.1×1{0}^{-5}}$mol/L=3.0×10-2=0.03mol/L;
故答案为:SO42-+Ba2+=BaSO4↓;0.03;
(4)①若NH4SCN不再剩余的Ag+结合形成AgSCN白色沉淀,溶液中就会含有SCN-,就会与Fe3+产生络合物是溶液变为红色,因此滴定达到终点时溶液由无色变为血红色,且30 s不褪色;
故答案为:当加入最后1滴NH4SCN溶液时,溶液由无色变为血红色,且30 s不褪色;
②n(NH4SCN)=0.2000mol/L×0.02L=4.0×10-3mol,Ag+以AgSCN白色沉淀的形式析出,所以溶液中剩余的Ag+的物质的量为:n(Ag+)=4.0×10-3mol,则与Cl-反应的Ag+的物质的量为:n(Ag+)=1×10-2 mol-4.0×10-3mol=6.0×10-3mol,
1.000g产品中SrCl2•6H2O的物质的量为:n(SrCl2•6H2O)=$\frac{1}{2}$×n(Ag+)=3×10-3mol,
1.000g产品中SrCl2•6H2O的质量为:m(SrCl2•6H2O)=3×10-3mol×267 g/mol=0.801g,
所以产品纯度为:$\frac{0.801g}{1g}$×100%=80.1%;
故答案为:80.1%;
(5)由SrCl2•6H2O晶体制取无水氯化锶的仪器有酒精灯、泥三角、三脚架、坩埚;
故答案为:坩埚.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中发生的化学反应及物质分离方法为解答的关键,涉及反应速率、氧化还原反应、滴定原理等,注意信息与所学知识的综合应用,综合性较强,题目难度中等.

| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ④ | |||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)⑤⑦形成化合物的电子式
 .②形成的最高价氧化物的结构式O=C=C.
.②形成的最高价氧化物的结构式O=C=C.(3)最高价氧化物是两性氧化物的元素其元素符号是Al;写出它的氢氧化物与⑧的最高价氧化物的水化物反应的离子方程式Al(OH)3+3H+=Al3++3H2O.
(4)⑥的单质与⑤的最高价氧化物的水化物反应的离子方程式是2Al+2H2O+2OH-=2AlO2-+3H2↑.
(5)②和⑦可形成原子数1:2的液态化合物甲,并能溶解⑦的单质,用电子式表示甲的形成过程:
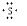 +
+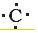 +
+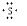 →
→ .
. | A. | Cl2 | B. | Na2O2 | C. | Na2O | D. | NaOH |
| A. | 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br- | |
| C. | 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| D. | 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为CO32-+2H+=CO2↑+H2O |
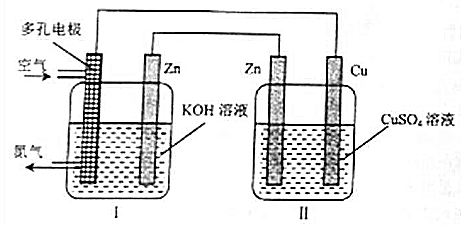
| A. | Cu电极质量增加 | |
| B. | 装置Ⅱ将化学能转变为电能 | |
| C. | 装置Ⅰ中OH-向多孔电极移动 | |
| D. | 多孔电极的电极反应式为:O2+4e-+2H2O═4OH- |
| A. | 13g乙炔中含有共用电子对的数目为1.5NA | |
| B. | 含有2NA个氧原子的氧气和臭氧的混合气体的质量为32g | |
| C. | 1 mol•L-1碳酸钠溶液中含有的碳酸根离子的数目小于NA | |
| D. | 标准状况下,将22.4LCl2通入水中发生反应,转移的电子数为NA |
| A. | 1 mo1H2O分子所含中子数为8NA | |
| B. | 30g乙烷中所含的共价键数为6 NA | |
| C. | 常温下,1LpH=1的H2SO4溶液中,含有H+的数目为0.2 NA | |
| D. | 100 mL0.1mol•L-1的CuCl2溶液中,含有Cu2+的数目为0.01 NA |
| 选项 | 方案 | 目的 |
| A | 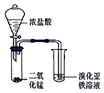 | 验证氧化性::Cl2>Br2 |
| B |  | 验证溶解度:AgCl>Ag2S |
| C | 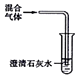 | 检验SO2、CO2混合气体中有CO2 |
| D | 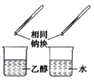 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
| A. | A | B. | B | C. | C | D. | D |
