题目内容
 氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法.用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO?2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法.用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO?2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:| 时间(s) | 0 | 2 | 4 |
| c(NO) ( mol?L-1) | 1.00×10-3 | 2.50×10-4 | 1.00×10-4 |
| c(CO) ( mol?L-1) | 3.60×10-3 | c′ | 2.70×10-3 |
(1)前4s内的平均反应速率v(NO)=
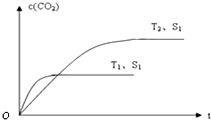
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图表示在其他条件不变时,上述反应中二氧化碳浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.
①该反应的△H
②若催化剂的表面积S1>S2,在答题卡图中画出c(CO2) 在T2、S2条件下达到平衡过程中的变化曲线.
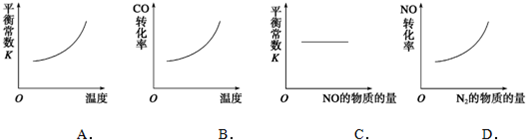
(3)在恒容的密闭容器中,上述反应达到平衡后,改变某一条件,下列示意图正确的是
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据前4s内△c(NO)变化,计算v(NO);NO浓度变化与CO浓度变化之比为化学方程式计量数之比,计算可得;
(2)①根据到达平衡的时间,判断温度高低,再根据不同温度下到达平衡时CO2的浓度高低,判断温度对平衡的影响,据此判断反应热效应;
②催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时CO2的浓度相同,据此作图;
(3)根据化学平衡移动时各物理量的变化判断.
(2)①根据到达平衡的时间,判断温度高低,再根据不同温度下到达平衡时CO2的浓度高低,判断温度对平衡的影响,据此判断反应热效应;
②催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时CO2的浓度相同,据此作图;
(3)根据化学平衡移动时各物理量的变化判断.
解答:
解:(1)前4s内△c(NO)=1.00×10-3mol/L-1.00×10-4mol/L=9.9×10-4mol/L,v(NO)=
=2.25×10-4 mol/(L?s);2s时,△c(NO)=1.00×10-3mol/L-2.50×10-4mol/L=7.5×10-4mol/L,NO和CO计量数之比为1:1,即,△c(CO)=,△c(NO)=7.5×10-4mol/L,所以2s时,c(CO)=3.60×10-3mol/L-7.5×10-4mol/L=2.85×10-3mol/L,故答案为:2.25×10-4 mol/(L?s);2.85×10-3mol/L;
(2)①、温度T1到达平衡的时间短,反应速率快,故温度T2<T1,温度越高,平衡时CO2的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
②、催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时CO2的浓度相同,故c(CO2) 在T1、S2条件下达到平衡过程中的变化曲线为: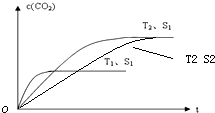 ,故答案为:
,故答案为: ;
;
(3)A、该反应为气体计量数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,故A错误;
B、升高温度,平衡逆向移动,CO的转化率减小,故B错误;
C、平衡常数只与热效应有关,与物质的量无关,故C正确;
D、增加氮气的物质的量,平衡逆向移动,NO的转化率减小,故D错误;
故选C.
| 9.9×10-4mol/L |
| 4s |
(2)①、温度T1到达平衡的时间短,反应速率快,故温度T2<T1,温度越高,平衡时CO2的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
②、催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时CO2的浓度相同,故c(CO2) 在T1、S2条件下达到平衡过程中的变化曲线为:
 ,故答案为:
,故答案为: ;
;(3)A、该反应为气体计量数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,故A错误;
B、升高温度,平衡逆向移动,CO的转化率减小,故B错误;
C、平衡常数只与热效应有关,与物质的量无关,故C正确;
D、增加氮气的物质的量,平衡逆向移动,NO的转化率减小,故D错误;
故选C.
点评:本题主要考查化学反应速率、影响化学平衡的因素、化学平衡图象以及热化学方程式的书写等,难度不大,中注意根据“先拐先平数值大”原则判断温度高低是关键,作图时注意到达平衡的时间与平衡时NO的浓度.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
下列事实不能用勒夏特列原理解释的是( )
| A、工业制取金属钾:Na(l)+KCl(l)?NaCl(l)+K(g),选取适宜的温度,使K成蒸汽从反应混合物中分离出来 |
| B、开启啤酒瓶时,有大量泡沫状气泡涌出瓶口 |
| C、工业合成氨气,采用铁触媒,并在500℃进行反应 |
| D、对于2HI(g)?H2(g)+I2(g);△H>0,升高温度可使颜色变深 |
下列氧化还原反应方程式,所标电子转移方向与数目错误的是( )
A、 |
B、 |
C、 |
D、 |
 在某一容积为5L的密闭容器内,加入0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:
在某一容积为5L的密闭容器内,加入0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应: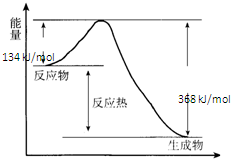 在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.
在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.