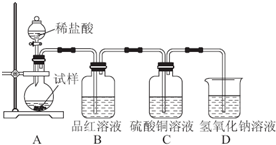
题目内容
2.如图所示是工业生产硝酸铵的流程图.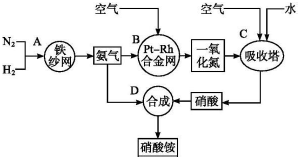
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:N2+3H2$?_{△}^{铁}$2NH3.
(2)B装置中Pt-Rh合金网的作用是催化剂
(3)写出B中的反应方程式:4NH3+5O2$\frac{\underline{\;Pt-Rh合金网\;}}{\;}$4NO+6H2O.
(4)写出D中的反应方程式:NH3+HNO3=NH4NO3.
(5)吸收塔C中通入空气的目的是利用空气中的氧气将NO氧化.
分析 从流程图可知,N2和H2在红热铁砂网的催化作用下合成氨气,氨气和空气中的O2在铂铑合金网的催化作用下发生催化氧化生成NO和H2O,将NO和空气、水混合,NO和O2和水反应生成HNO3,然后NH3和HNO3反应生成NH4NO3,据此分析.
解答 解:从流程图可知,N2和H2在红热铁砂网的催化作用下合成氨气,氨气和空气中的O2在铂铑合金网的催化作用下发生催化氧化生成NO和H2O,将NO和空气、水混合,NO和O2和水反应生成HNO3,然后NH3和HNO3反应生成NH4NO3.
(1)N2和H2在红热铁砂网的催化作用下合成氨气,化学方程式为:N2+3H2$?_{△}^{铁}$2NH3,故答案为:N2+3H2$?_{△}^{铁}$2NH3;
(2)B装置中在的催化作用下,氨气和氧气发生催化氧化反应,故答案为:催化剂;
(3)B装置中在Pt-Rh合金网的催化作用下,氨气和氧气发生催化氧化反应生成NO和H2O,化学方程式为:4NH3+5O2$\frac{\underline{\;Pt-Rh合金网\;}}{\;}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{\;Pt-Rh合金网\;}}{\;}$4NO+6H2O;
(4)在D中,NH3和HNO3反应生成NH4NO3,故化学方程式为:NH3+HNO3=NH4NO3,故答案为:NH3+HNO3=NH4NO3;
(5)在C中,将NO和空气、水混合后,NO和O2和水反应生成HNO3,其中氧气做氧化剂,故答案为:利用空气中的氧气将NO氧化.
点评 本题考查了热化学方程式的意义,明确工业合成氨为可逆反应,熟悉常见的反应的书写是解题关键,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
13.某烃结构式如下: -C≡C-CH=CH-CH3,有关其结构说法正确的是( )
-C≡C-CH=CH-CH3,有关其结构说法正确的是( )
 -C≡C-CH=CH-CH3,有关其结构说法正确的是( )
-C≡C-CH=CH-CH3,有关其结构说法正确的是( )| A. | 所有碳原子不可能在同一平面上 | B. | 所有碳原子可能在同一条直线上 | ||
| C. | 碳原子同一平面上至少有9个 | D. | 所有原子可能在同一平面上 |
10.下列说法正确的是( )
| A. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原性二糖 | |
| B. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略体积的变化)测得混合溶液的pH=5,则混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| C. | 纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体 | |
| D. | 已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol•L-1的AgNO3溶液和1×10-4 mol•L-1 K2CrO4溶液混合后会有Ag2CrO4沉淀产生 |
7.根据等电子原理:由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特征.以下各组微粒结构不相似的是( )
| A. | CO和N2 | B. | O3和NO2- | C. | N2H4和C2H4 | D. | CO2和N2O |
14.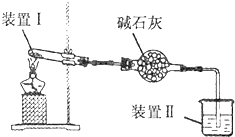 按如图所示装置进行实验,装置中现象II不正确的是( )
按如图所示装置进行实验,装置中现象II不正确的是( )
 按如图所示装置进行实验,装置中现象II不正确的是( )
按如图所示装置进行实验,装置中现象II不正确的是( )| 选项 | 装置I中试剂 | 装置Ⅱ中试剂 | 装置Ⅱ中现象 |
| A | 浸透了石蜡油的石棉和碎瓷片 | 酸性高锰酸钾溶液 | 紫色溶液褪色 |
| B | 铁粉和用水浸泡的棉团 | 肥皂水 | 肥皂水冒泡 |
| C | 碳酸氢钠 | 澄清石灰水 | 有沉淀生成 |
| D | 硫酸铵 | 酚酞溶液 | 溶液变红 |
| A. | A | B. | B | C. | C | D. | D |
11.3,8-癸二醇是一种医药中间体,其结构式如图.下列关于3,8-癸二醇的叙述正确的是( )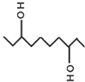

| A. | 该有机物的分子式为C10H20O2 | |
| B. | 该有机物与乙二醇、甘油互为同系物 | |
| C. | 1mol该有机物一定条件下与Na完全反应最多可生成22.4L氢气 | |
| D. | 该有机物一定条件下,可以发生取代、氧化、酯化反应 |
12.从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:

下列说法正确的是( )

下列说法正确的是( )
| A. | 丙中一定含有羧基 | B. | 甲不可以与HBr发生取代反应 | ||
| C. | 甲、乙、丙都能发生氧化反应 | D. | 可以用溴水检验乙中的碳碳双键 |