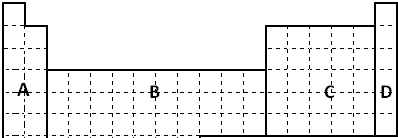
题目内容
下列离子反应方程式中,属于水解反应的是( )
| A、AlO2-+2H2O?Al(OH)3+OH- |
| B、HCO3-+H2O?H3O++CO32- |
| C、HCO3-+OH-═CO32-+H2O |
| D、NH3+H2O?OH-+NH4+ |
考点:盐类水解的原理
专题:盐类的水解专题
分析:水解反应为弱酸或弱碱离子结合生成水电离的氢离子或氢氧根离子生成弱电解质的反应,以此来解答.
解答:
解:A、偏铝酸根离子结合水电离出的氢离子,形成氢氧化铝和,溶液显示碱性,属于水解方程式,故A正确;
B、HCO3-+H2O?H3O++CO32-为HCO3-的电离反应,故B错误;
C、碳酸氢根离子和氢氧根离子之间反应生成碳酸根离子和水,不属于水解反应,是发生了化学反应,故C错误;
D、NH3+H2O?NH3?H2O?OH-+NH4+是一个氨气溶于水后一水合氨的电离过程,故D错误;
故选A.
B、HCO3-+H2O?H3O++CO32-为HCO3-的电离反应,故B错误;
C、碳酸氢根离子和氢氧根离子之间反应生成碳酸根离子和水,不属于水解反应,是发生了化学反应,故C错误;
D、NH3+H2O?NH3?H2O?OH-+NH4+是一个氨气溶于水后一水合氨的电离过程,故D错误;
故选A.
点评:本题考查离子反应方程式的书写,明确水解与电离的区别是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
某氨水中c(NH4+)=0.5mol/L时达到电离平衡,若向其中加入c(NH4+)=0.5mol/L的NH4Cl溶液后,NH3?H2O的电离程度将( )
| A、减少 | B、不变 |
| C、增大 | D、无法判断 |
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+4OH-═Y+S4O62-+2H2O,下列有关说法正确的是( )
| A、Y的化学式为Fe2O3 |
| B、S4O62-是还原产物 |
| C、被1mol O2氧化的Fe2+物质的量为1mol |
| D、每 32 gO2参加反应,转移电子的物质的量为4mol |
2003年诺贝尔物理学奖颁给三位对超导和超流理论方面进行研究并作出先驱性贡献的科学家.低温液态的42He和32He具有超流体特性.关于42He说法错误的是( )
| A、质子数为2 |
| B、电子数为2 |
| C、质量数为4 |
| D、中子数为4 |
下列化学方程式或离子方程式正确的是( )
A、苯酚钠溶液中通入少量二氧化碳的离子方程式: |
B、制备酚醛树脂的化学方程式: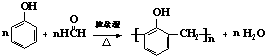 |
C、丙烯聚合成聚丙烯的化学方程式: |
| D、丙烯与溴化氢主反应为:CH3-CH=CH2+HBr→CH3-CH2-CHBr |
下列关于蛋白质的叙述中,不正确的是( )
| A、蛋白质水解的最终产物为葡萄糖 |
| B、酒精消毒的原理是酒精能使蛋白质变性 |
| C、重金属盐能使蛋白质变性凝结,所以误食重金属盐会中毒 |
| D、浓硝酸溅在皮肤上,使皮肤呈黄色是由于浓硝酸和蛋白质发生了颜色反应 |