题目内容
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+4OH-═Y+S4O62-+2H2O,下列有关说法正确的是( )
| A、Y的化学式为Fe2O3 |
| B、S4O62-是还原产物 |
| C、被1mol O2氧化的Fe2+物质的量为1mol |
| D、每 32 gO2参加反应,转移电子的物质的量为4mol |
考点:氧化还原反应
专题:氧化还原反应专题
分析:由质量守恒可知Y为Fe3O4,由反应的离子方程式可知反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,反应中Fe和S元素的化合价升高,被氧化,O2为氧化剂,结合元素化合价的变化解答该题.
解答:
解:A.据质量守恒可知,Y为化合物,反应前后的原子个数相等,则Y为Fe3O4,故A错误;
B.反应中S元素化合价升高,被氧化,则S4O62-为氧化产物,故B错误;
C.Fe3O4中,Fe元素化合价有+2价和+3价,1molFe3O4中有2molFe为+3价,被1mol O2氧化的Fe2+物质的量为2mol,故C错误;
D.每 32 gO2参加反应,即1mol氧气,则转移电子的物质的量为4mol,故D正确.
故选D.
B.反应中S元素化合价升高,被氧化,则S4O62-为氧化产物,故B错误;
C.Fe3O4中,Fe元素化合价有+2价和+3价,1molFe3O4中有2molFe为+3价,被1mol O2氧化的Fe2+物质的量为2mol,故C错误;
D.每 32 gO2参加反应,即1mol氧气,则转移电子的物质的量为4mol,故D正确.
故选D.
点评:本题考查氧化还原反应的基本概念与计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型,注意Fe3O4是复杂的化合物,铁元素既有+2价也有+3价,把Fe3O4中铁元素的化合价用平均化合价处理,S2O32-的硫元素的化合价用平均化合价处理是解本题的关键,本题难度较大,需细心分析.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列变化规律中正确的是( )
| A、金属Na、Mg、A1熔、沸点由高到低 |
| B、HC1、HBr、HI的还原性由强到弱 |
| C、H+、Li+、H- 的半径由小到大 |
| D、同浓度的硫酸钠、醋酸钠、碳酸钠溶液的碱性由强到弱 |
下列离子反应方程式中,属于水解反应的是( )
| A、AlO2-+2H2O?Al(OH)3+OH- |
| B、HCO3-+H2O?H3O++CO32- |
| C、HCO3-+OH-═CO32-+H2O |
| D、NH3+H2O?OH-+NH4+ |
在以下各种情形下,下列电离方程式或离子方程式书写正确的是( )
| A、熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO42- |
| B、H2CO3的电离:H2CO3?2H++CO32- |
| C、Fe(OH)3的电离:Fe(OH)3?Fe3++3OH- |
| D、Na2CO3的水解:CO32-+2H2O?H2CO3+2OH- |
下列反应的离子方程式书写正确的是( )
| A、氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-=BaSO4↓ |
| B、稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| C、氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |
| D、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下图所示.下列说法正确的是
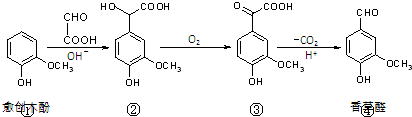 ( )
( )
 ( )
( )| A、在上述三步反应中理论上只有①生成②的反应原子利用率为100% |
| B、氯化铁溶液和碳酸氢钠溶液都能鉴别③④ |
| C、②分子中C原子不可能在同一平面上 |
| D、等物质的量的①②分别与足量NaOH溶液反应,消耗NaOH的物质的量之比为1:3 |
将一小块钠投入滴有石蕊的水中,下列有关现象的叙述错误的是( )
| A、钠浮在液面上 |
| B、有无色无味的气体产生 |
| C、水溶液变为蓝色 |
| D、水溶液变为红色 |
