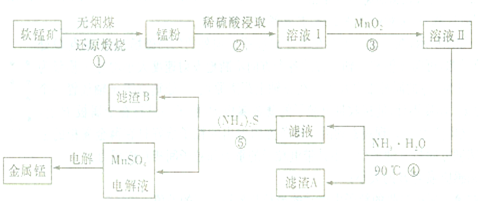
题目内容
6. 氨基乙酸铜分子结构如图,碳原子的杂化方式为sp3、sp2,基态碳原子核外电子有6个空间运动状态.
氨基乙酸铜分子结构如图,碳原子的杂化方式为sp3、sp2,基态碳原子核外电子有6个空间运动状态.
分析 根据价层电子对互斥理论判断C原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,如果价层电子对个数是4,则C原子采用sp3杂化,如果价层电子对个数是3,则C原子采用sp2杂化,如果价层电子对个数是2,则C原子采用sp杂化.原子核外电子运动状态和该原子的核外电子数相等,据此分析解答.
解答 解:氨基乙酸铜的分子中一种碳有碳氧双键,C原子含有3个σ键,碳的杂化方式为sp2杂化,另一种碳周围都是单键,C原子含有4个σ键,碳的杂化方式为sp3杂化,C原子具有6个核外电子,处于不同能层、能级上的电子具有的能量不同,同一能级上的电子自旋方向相反,故有6种不同的运动状态,
故答案为:sp3、sp2;6.
点评 本题考查原子杂化方式判断、核外电子空间运动状态种类,明确价层电子对互斥理论是解本题关键,知道价层电子对个数的计算方法,为考试高频点,注意原子核外电子运动状态和该原子的核外电子数相等,题目难度中等.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
16.NA为阿伏伽德罗常数的值,下列叙述错误的是( )
| A. | 18 g H2O中含的质子数为10 NA | |
| B. | 12 g金刚石含有的电子数为4 NA | |
| C. | 46 g NO2和N2O4混合气体中含有原子总数为3 NA | |
| D. | 23 g Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
17.下列有机物的命名不正确的是( )
| A. | 2,3,3一三甲基戊烷 | B. | 2-甲基-2-丁烯 | ||
| C. | 3,3一二甲基-4-乙基戊烷 | D. | 3,3,4一三甲基已烷 |
14.下列分子中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠构建而成的是( )
| A. | H2 | B. | Cl2 | C. | NaH | D. | HF |
11.下列实验装置或操作能达到目的且现象描述正确的是( )

| A. | 装置①:制取乙炔并验证炔烃的性质;溴水褪色 | |
| B. | 装置②:检验乙醇的氧化性;溶液颜色从绿色变成橙色 | |
| C. | 装置③:验证葡萄糖分子中含有醛基官能团;出现银镜 | |
| D. | 装置④:验证碳酸的酸性比苯酚的酸性强;溶液变浑浊 |
18.下列图示与对应的叙述相符的是( )
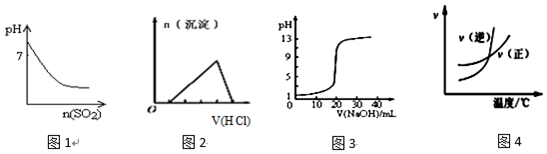

| A. | 图1表示将SO2气体通入溴水中,所得溶液的pH变化 | |
| B. | 图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀的物质的量与盐酸体积的关系 | |
| C. | 图3表示常温下,向0.1000mol•L-1HCl溶液中滴加20.00mL 0.1000mol•L-1氨水的滴定曲线 | |
| D. | 图4表示乙醇的催化氧化反应中速率随温度的变化图象,升高温度该反应的平衡常数减小 |