题目内容
12. H2O和CS2分子中的原子都达到稳定结构.
H2O和CS2分子中的原子都达到稳定结构.(1)上述四种元素电负性由大到小的顺序是:O>S>C>H.
(2)上述四种元素第一电离能比同周期相邻两种元素都小的元素是:O、S.
(3)CS2分子中σ键与π键的数目比为:1:1.
(4)用“大于”、“小于”或“等于”回答本问题:
①CS2在其晶体中的配位数大于H2O在其晶体中的配位数
②硫氰酸(H-S-C≡N)的熔点小于异硫氰酸(H-N=C=S)的熔点
(5)已知TiCl4熔点为37℃,沸点为136℃,熔融态不导电,可知TiCl4为分子晶体.
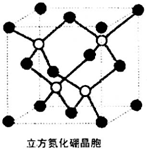
(6)六方氮化硼(BN)的晶胞结构如图所示.
①晶胞内的四个原子(如白球所示)所形成的空间结构为正四面体形
②硼原子的杂化方式为sp3.
③晶胞边长为a nm则其密度为$\frac{1×1{0}^{23}}{{N}_{A}×{a}^{3}}$g•cm-3(设阿伏加德罗常数的值为NA)
分析 (1)原子的得电子能力越强,其电负性的数值越大,即非金属性越强电负性越大;
(2)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;
(3)根据CS2分子的结构简式分析,双键中含有1个σ键、1个π键,单键属于σ键;
(4)①直接同中心原子配位的原子数为配位数,结合CS2、H2O晶体结构解答;
②异硫氰酸分子间可形成氢键;
(5)根据题目中提供的物理性质来判断晶体类型从而判断化合物类型;
(6)①晶胞内的四个原子(如白球所示)所形成的空间结构为正四面体形;
②根据杂化理论判断,立方相氮化硼晶体中,硼原子形成4个σ键、没有孤电子对;
③立方氮化硼中,晶胞边长为a pm=a×10-10cm,晶胞体积V=(a×10-10cm)3,该晶胞中N原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B原子个数为4,根据$\frac{m}{v}$计算密度.
解答 解:(1)同周期从左向右电负性逐渐增大,O>C,同主族自上而下电负性减小,O>S,非金属性越强电负性越大,故电负性大小为O>S>C>H,
故答案为:O>S>C>H;
(2)同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的轨道上的电子半满,能量比相邻两种元素低,不易失去一个电子,所以大于第ⅥA族的,所以其第一电离能比同周期相邻两种元素都小的元素是O、S,
故答案为:O、S;
(3)CS2分子结构式为:S=C=S,双键中含有1个σ键、1个π键,单键属于σ键,故CS2分子中σ键与π键数目之比为1:1,
故答案为:1:1;
(4)①CS2呈立方最密堆积(立方面心堆积,在其晶体中的配位数为12,H2O呈面心立方晶胞,在其晶体中的配位数为8,所以CS2在其晶体中的配位数大于H2O在其晶体中的配位数,
故答案为:大于;
②由于异硫氰酸分子间可形成氢键而硫氰酸分子间不能形成氢键,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸,
故答案为:小于;
(5)已知TiCl4熔点为37℃,沸点为136℃,熔融态不导电,由此可判断 TiCl4是由共价键结合的分子,
故答案为:分子;
(6)①立方氮化硼晶胞,每个N原子被4个B原子共用、每个B原子被4个N原子共用,晶胞内的四个原子(如白球所示)所形成的空间结构为正四面体形,
故答案为:正四面体;
②立方相氮化硼晶体中,硼原子形成4个σ键、没有孤电子对,杂化轨道数目为4,采取sp3杂化,
故答案为:sp3;
③立方氮化硼中,晶胞边长为a cm,晶胞体积V=(acm)3,该晶胞中N原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B原子个数为4,立方氮化硼的密度=$\frac{4M}{\frac{{N}_{A}}{V}}$=$\frac{4×25}{{N}_{A}×(a×1{0}^{-7}cm)^{3}}$=$\frac{1×1{0}^{23}}{{N}_{A}×{a}^{3}}$g/cm3,
故答案为:$\frac{1×1{0}^{23}}{{N}_{A}×{a}^{3}}$.
点评 本题考查电负性、第一电离能、晶胞结构、性质等知识的应用,题目综合性较强,晶胞的结构分析和计算是难点,题目难度中等.

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案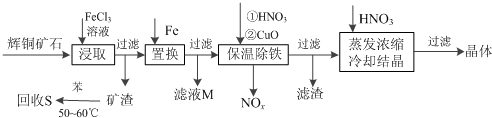
已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
(2)气体NOx 与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为4NOx+(5-2x)O2+2H2O=4HNO3
(3)可向滤液M中加入(或通入)下列D(填字母)物质,得到较多的另一种可循环利用的物质.
A.Fe B.NaClO C.H2O2 D.Cl2
(4)蒸发浓缩时,要用硝酸调节溶液的pH,其作用是调节溶液pH使使铁元素完全转化为氢氧化铁沉淀,抑制铜离子水解.
(5)在除铁阶段,如果pH控制不当会使产量降低.你认为应该采取的补救措施是:将滤渣加入到HNO3中将pH调为3.7-4.7,充分反应后过滤,将滤液与原滤液合并.
| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移的电子数目为0.4NA | |
| B. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA | |
| C. | 在30g二氧化硅晶体中含有的共价键数目为2NA | |
| D. | 将常温下含NA个NO2、N2O4分子的混合气体冷却至标准状况,其体积约为22.4L |
| A. | 常温下,能稳定存在的R的氧化物都是酸性氧化物 | |
| B. | R的气态氢化物的水溶液具有强酸性 | |
| C. | R是金属元素 | |
| D. | R的气态氧化物不能在氧气中燃烧 |
| A. | 倭铅是指金属锌和铅的混合物 | |
| B. | 煤炭中起作用的主要成分是C | |
| C. | 冶炼Zn的反应方程式为:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑ | |
| D. | 该冶炼锌的方法属于热还原法 |
| A. |  检验铁粉与水蒸气反应产生的氢气 | |
| B. |  快速制备和收集一定量的氨气 | |
| C. |  分离互溶但沸点相差较大的液体混合物 | |
| D. |  直接蒸发氯化铁溶液获得氯化铁晶体 |
| A. | 羊毛、棉花、淀粉都是自然界存在的天然高分子化合物 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜单质 | |
| C. | 霾是悬浮在大气中的大量微小尘粒、烟粒或盐粒的集合体,霾的形成与PM2.5有直接关系 | |
| D. | 一些有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低且极易被引燃,加热时最好用水浴加热 |
| A. | 绿色化学的核心是从源头上防止和消除化工生产对环境的污染 | |
| B. | 减少化石燃料的使用,有利于降低空气中pM2.5的数值 | |
| C. | “地沟油”禁止食用,但可以用来制柴油、肥皂等 | |
| D. | 淀粉、豆油、蛋白质都是天然高分子化合物 |