题目内容
7.下列有关“电离平衡”的叙述正确的是( )| A. | 电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等 | |
| B. | 电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是静态平衡 | |
| C. | 电离平衡是相对有、暂时的、外界条件改变时,平衡就会发生移动 | |
| D. | 电解质达到电离平衡后,各种离子的浓度相等 |
分析 A.电解质在溶液里达到电离平衡时,溶质电离出的离子浓度不一定相等;
B.电离平衡时,溶液中分子和离子浓度不再改变;
C.电离平衡是相对的、暂时的,与外界条件有关,外界条件改变,则平衡改变;
D.电解质达到电离平衡后,分子的浓度和离子的浓度不变,但不一定相等.
解答 解:A.电解质在溶液里达到电离平衡时,溶质电离出的离子浓度不一定相等,如:碳酸在水中电离出的离子有氢离子、碳酸根离子、碳酸氢根离子,碳酸电离出的离子浓度大小顺序是:C(H+)>C(HCO3-)>C(CO3 2- ),故A错误;
B.电离平衡时,溶液中分子和离子浓度不再改变,但电离没有停止,只是弱电解质的电离和生成速率相等,所以说电离平衡是动态平衡,故B错误;
C.电离平衡是相对的、暂时的,与外界条件有关,外界条件改变,则平衡被打破,建立新的平衡,故C正确;
D.电解质达到电离平衡后,分子的浓度和离子的浓度不变,但不一定相等,如25℃时,醋酸溶液中,醋酸的电离度较小,醋酸只有小部分电离,所以醋酸分子浓度和醋酸根离子浓度不相等,故D错误;
故选C.
点评 本题考查了弱电解质的电离,注意弱电解质的电离是吸热反应,所以弱电解质的电离程度与温度有关,升高温度促进电离.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
4.下列实验所对应的离子方程式正确的是( )
| A. | 向漂白粉溶液中通入SO2:Ca2++ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O | |
| D. | 向Na2S2O3溶液中加入稀硫酸:S2O32-+4H+═SO42-+3S↓+2H2O |
5.下列有关实验设计、观察或记录、结论或解释都正确的是( )
| 选项 | 实验设计 | 观察或记录 | 结论或解释 |
| A | 将浓硝酸分多次加入Cu和稀硫酸的混合液中 | 产生红棕色气体 | 浓硝酸的还原产物是NO2 |
| B | 测某铵盐溶液的pH | pH>7 | NH4+水解生成NH3•H2O,使溶液显碱性 |
| C | 用湿润的淀粉碘化钾试纸检验某气体 | 试纸变蓝 | 该气体一定是Cl2 |
| D | 将20mL pH均为1的盐酸和醋酸分别加水稀释至pH为3 | 醋酸的体积变化大 | 醋酸是弱酸 |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法正确的是( )
| A. | 淀粉、油脂、蛋白质都能发生水解反应,都属于天然有机高分子 | |
| B. | 乙醇和2-丙醇( )属于同系物,其催化氧化的产物也属于同系物c )属于同系物,其催化氧化的产物也属于同系物c | |
| C. | 等质量的乙酸和葡萄糖完全燃烧,消耗氧气的量相等 | |
| D. | 淀粉、纤锥素、蔗糖都属于天然高分子化合物,而且水解产物中都有葡萄糖 |
16.下列实验操作中有错误的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 实验室制取蒸馏水的装置中,温度计水银球应位于蒸馏烧瓶的支管口处 | |
| C. | 用萃取的方法分离碘水 | |
| D. | 用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干 |
17.某微粒的结构示意图为 ,当x-y=10时,该微粒为( )
,当x-y=10时,该微粒为( )
 ,当x-y=10时,该微粒为( )
,当x-y=10时,该微粒为( )| A. | 原子 | B. | 阳离子 | C. | 阴离子 | D. | 无法判断 |
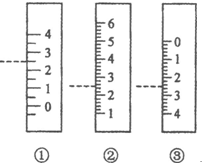 以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:
以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:
 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下: