题目内容
5.下列说法正确的是( )| A. | 冰的晶体中每个水分子可与周围两个水分子形成氢键 | |
| B. | 手性碳原子不一定是饱和碳原子 | |
| C. | 区分晶体与非晶体最科学的方法是X-射线衍射法 | |
| D. | 晶体中有阳离子就一定有阴离子 |
分析 A、冰晶体中水分子间除了范德华力之外还存在氢键,由于氢键具有方向性,故每个水分子周围只有4个紧邻的水分子;
B、只有碳原子连接四个不同的基团或原子才具有手性;
C、X-射线衍射法是区分晶体与非晶体最科学的方法;
D、金属晶体的构成微粒是金属阳离子和自由电子.
解答 解:A.冰的晶体中每个水分子可与周围四个水分子形成氢键,故A错误;
B.只有碳原子连接四个不同的基团或原子才具有手性,则碳原子一定是饱和碳原子,故B错误;
C.X-射线衍射法是区分晶体与非晶体最科学的方法,故C正确;
D.晶体中有阳离子不一定有阴离子,如金属晶体,故D错误;
答选:C.
点评 本题考查氢键、手性碳和晶体的构成微粒,难度不大,注意碳原子上连接四个不同的基团或原子才具有手性,所以碳原子一定饱和.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列说法正确的是( )
| A. | Cu和浓硫酸在加热的条件下可以反应,体现浓硫酸的强氧化性和酸性 | |
| B. | 将SO2通入盛有品红溶液的试管中红色褪去,给试管加热无明显变化 | |
| C. | 将干燥的Cl2通入装有红色鲜花的试管中,红花褪色,说明Cl2具有漂白性 | |
| D. | 将蘸有浓氨水和浓硫酸的玻璃棒靠近,会产生白烟 |
13.下列化合物的分子中,所有原子均处于同一平面的是( )
| A. | 丙烯 | B. | 氯乙烷 | C. | 甲苯 | D. | 溴苯 |
20.工业上生产Na、Ca、Mg都用电解熔融的氯化物,但K不能用电解熔融态的方法得到,因金属钾易溶于熔融态的KCl而有危险,很难制得K,且降低电流效率.现生产钾是用金属钠和KCl在850℃反应制取,有关的反应式为:KCl+Na=NaCl+K↑下列说法错误的是( )
| A. | 该反应850℃的选择是基于熔沸点的考虑 | |
| B. | 该反应不能在空气中进行 | |
| C. | 该反应属于置换反应的类型 | |
| D. | 该反应表明钠比钾的活动性强 |
10.下列图象能正确反映其对应关系的是( )
| A. | 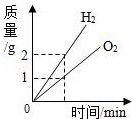 电解水生成氢气和氧气的质量与反应时间的关系 | |
| B. | 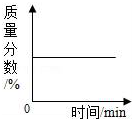 加热一定量高锰酸钾固体制氧气,剩余固体中锰元素的质量分数与反应时间的关系 | |
| C. | 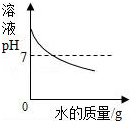 向氢氧化钠溶液中不断加水,溶液PH与加入水的质量关系 | |
| D. | 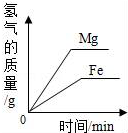 相同质量的Mg、Fe分别与足量的稀盐酸反应,产生氢气的质量与反应时间的关系 |
17.将铜和碳的混合物在空气中充分灼烧,混合物的质量在冷却后没有变化,则原混合物中铜和碳的质量比为( )
| A. | 1:1 | B. | 1:4 | C. | 4:1 | D. | 无法确定 |
14.0.1mol•L-1CH3COOH溶液中,如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入水时,溶液中离子浓度都减小 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol•L-1CH3COOH溶液,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,电离平衡常数减小 |
8.某有机物的结构简式如图所示:下列有关该有机物的叙述正确的是( )


| A. | 该有机物的分子式为C11H14O3 | |
| B. | 该有机物可能易溶于水且具有水果香味 | |
| C. | 该有机物可能发生的化学反应类型有:水解、酯化、氧化、取代 | |
| D. | 1mol该有机物在Ni作催化剂的条件下能与4molH2发生加成反应 |