题目内容
16.(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
①该反应的化学平衡常数表达式为:K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$.
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g.则10min内CO的平均反应速率为0.015mol/(L.min).
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到化学平衡状态:①CO或CO2的浓度不变,②CO或CO2的正逆反应速率相同.
分析 (1)①K为生成物浓度幂之积与反应物浓度幂之积的比;
②n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,由反应可知消耗CO为0.2mol×$\frac{3}{2}$=0.3mol,结合v=$\frac{△c}{△t}$计算;
(2)利用等、定判定平衡状态.
解答 解:(1)①由Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),纯固体不能代入K的表达式中,则该反应的化学平衡常数表达式为K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,
故答案为:$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$;
②n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,由反应可知消耗CO为0.2mol×$\frac{3}{2}$=0.3mol,则10min内CO的平均反应速率为v=$\frac{△c}{△t}$=$\frac{\frac{0.3mol}{2L}}{10min}$=0.015mol/(L.min),
故答案为:0.015mol/(L.min);
(2)由反应及平衡的特征可知,CO或CO2的浓度不变、CO或CO2的正逆反应速率相同,均说明该反应已达到化学平衡状态,
故答案为:CO或CO2的浓度不变;CO或CO2的正逆反应速率相同.
点评 本题考查化学平衡常数及计算,为高频考点,把握平衡常数表达式、速率计算、平衡判定为解答的关键,注意固体不能在K的表达式中,题目难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
6.将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).可以判断该分解反应已经达到化学平衡的是( )
| A. | 密闭容器中二氧化碳的体积分数不变 | |
| B. | 密闭容器中气体的总物质的量改变 | |
| C. | 密闭容器中混合气体的密度不变 | |
| D. | 2v(NH3)正=v(CO2)逆 |
7.下列说法正确的是( )
| A. | 苯酚显酸性,是因为羟基对苯环影响的结果 | |
| B. | 分子式为C2H4和C3H6的物质一定互为同系物 | |
| C. | 聚合物  是苯酚和甲醛在一定条件下反应得到的高分子化合物 是苯酚和甲醛在一定条件下反应得到的高分子化合物 | |
| D. | 1mol 与足量的NaOH溶液加热充分反应,最多能消耗4mol NaOH 与足量的NaOH溶液加热充分反应,最多能消耗4mol NaOH |
4.1995年美国Lagow教授报道,他制得了碳的第四种同素异形体--链式炔碳:“ ”,该物质的一个分子中含有300~500个碳原子,性质很活泼.下列关于该链式炔碳的熔点判断正确的是( )
”,该物质的一个分子中含有300~500个碳原子,性质很活泼.下列关于该链式炔碳的熔点判断正确的是( )
 ”,该物质的一个分子中含有300~500个碳原子,性质很活泼.下列关于该链式炔碳的熔点判断正确的是( )
”,该物质的一个分子中含有300~500个碳原子,性质很活泼.下列关于该链式炔碳的熔点判断正确的是( )| A. | 比石墨高 | B. | 比石墨低 | ||
| C. | 低于石墨而高于金刚石 | D. | 无法判断 |
1.除去乙烷中乙烯所需的试剂和方法是( )
| A. | 溴水,洗气 | B. | 空气,点燃 | C. | 浓硫酸,洗气 | D. | 氢气,加热 |
8.下列硫化物中不能直接用金属单质和硫单质反应制得的是( )
| A. | CuS | B. | FeS | C. | ZnS | D. | MgS |
5.下列说法正确的是( )
| A. | 冰的晶体中每个水分子可与周围两个水分子形成氢键 | |
| B. | 手性碳原子不一定是饱和碳原子 | |
| C. | 区分晶体与非晶体最科学的方法是X-射线衍射法 | |
| D. | 晶体中有阳离子就一定有阴离子 |
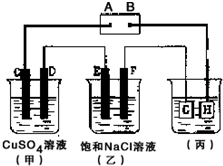 如图所示的装置,C、D、E、F 都是惰性电极.将电源接通后,观察到甲中C电极上有红色固体析出,电解一段时间后,C电极质量增加19.2g,试回答以下问题:
如图所示的装置,C、D、E、F 都是惰性电极.将电源接通后,观察到甲中C电极上有红色固体析出,电解一段时间后,C电极质量增加19.2g,试回答以下问题: