题目内容
19.下列叙述中错误的是( )| A. | 还原性:Na>Mg>Al>Fe | B. | 碱性:NaOH>KOH>Ca(OH)2 | ||
| C. | 稳定性:HF>HCl>HBr>HI | D. | 酸性:HClO4>H2SO4>CH3COOH>H2CO3 |
分析 A.根据金属活动性顺序表进行判断各元素的还原性;
B.金属性越强,则最高价氧化物对应水合物的碱性越强;
C.非金属性越强,对应氢化物的稳定性越强;
D.非金属性越强,最高价氧化物对应水合物的酸性越强.
解答 解:A.根据金属活动性顺序表可知,还原性大小为:Na>Mg>Al>Fe,故A正确;
B.金属性:Na<Ca<K,则最高价氧化物对应水合物的碱性:KOH>Ca(OH)2>NaOH,故B错误;
C.非金属性:F>Cl>Br>I,则对应氢化物的稳定性:HF>HCl>HBr>HI,故C正确;
D.非金属性:Cl>S>C,醋酸的酸性大于碳酸,则酸性大小为:HClO4>H2SO4>CH3COOH>H2CO3,故D正确;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,明确元素周期律内容为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
9.铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝.下列说法不正确的是( )
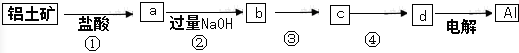

| A. | ①、②、③中除加试剂外,还需要进行过滤操作 | |
| B. | a、b中铝元素的化合价相同 | |
| C. | ③中需要通入过量的氨气 | |
| D. | ④进行的操作是加热,而且d一定是氧化铝 |
7.下列说法中正确的是( )
| A. | 欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,其方法是加入氢氧化钠固体 | |
| B. | 常温下,0.4 mol/LHB溶液和0.2 mol/LNaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为: c(B-)>c(H+)>c(Na+)>c(OH-) | |
| C. | 某温度下纯水的c(H+)=1.0×10-6mol/L,在此温度下,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合(溶液体积变化忽略不计).欲使混合溶液的pH=7,则氢氧化钡溶液与盐酸的体积比为2:9 | |
| D. | pH相等的下列溶液:a.CH3COOK、b.NaHCO3、c.Na2CO3、d.NaOH,其物质的量浓度由小到大顺序为:d<c<a<b |
14.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn-稀硫酸原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4中溶液,可与实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积;
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②反应一段时间后,实验A中的金属呈灰黑色色,实验E中的金属呈紫红色色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn-稀硫酸原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4中溶液,可与实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积;
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②反应一段时间后,实验A中的金属呈灰黑色色,实验E中的金属呈紫红色色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
4.将铁棒和锌棒用导线连接插入CuSO4溶液里,当电池中有0.2mol电子通过时,负极质量的变化是( )
| A. | 增加6.5 g | B. | 减少6.5 g | C. | 减少5.6 g | D. | 增加6.4 g |
11.在氯化铁、氯化铜和盐酸混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
| A. | Cu 2+ | B. | Fe 3+ | C. | Fe 2+ | D. | H + |
9.对常温下pH=3的 CH3COOH溶液,下列叙述不正确的是( )
| A. | c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 加入少量CH3COONa固体后,c(CH3COO-)降低 | |
| C. | 该溶液中由水电离出的 c(H+)是 1.0×10-11mol/L | |
| D. | 与等体积pH=11 的NaOH 溶液混合后所得溶液显酸性 |
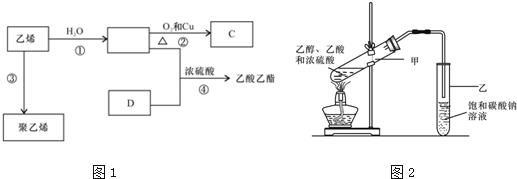
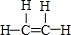 .
. CH3COOCH2CH3+H2O,反应类型:酯化反应或取代反应.
CH3COOCH2CH3+H2O,反应类型:酯化反应或取代反应.