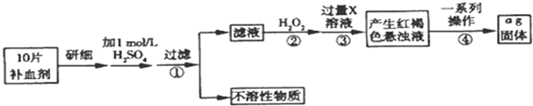
题目内容
3.在容积为1L的密闭容器中,加入1.0mol A和2.2mol B进行如下反应:A(g)+2B(g)?C(g)+D(g),在800℃时,D的物质的量n(D)和时间t的关系如图.(1)800℃时,0~5min内,以B表示的平均反应速率为0.24mol/(L.min).
(2)利用图中数据计算在800℃时的平衡常数的数值为0.9.
(3)若700℃,反应达平衡时,A的浓度为0.55mol/L,则该反应为吸热反应(填“吸热”或“放热”).
(4)800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06mol•L-1,c(B)=0.50mol•L-1,c(C)=0.20mol•L-1,c(D)=0.018mol•L-1,则此时该反应向正方向进行(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”).

分析 (1)0~5min内,v(D)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.6-0}{1}}{5}$mol/(L.min)=0.12mol/(L.min),v(B)=2v(D);
(2)开始时c(A)=1.0mol/L、c(B)=2.2mol/L,平衡时c(D)=0.6mol/L,
该反应中A(g)+2B(g)?C(g)+D(g),
开始(mol/L)1.0 2.2 0 0
反应(mol/L)0.6 1.2 0.6 0.6
平衡(mol/L)0.4 1.0 0.6 0.6
化学平衡常数K=$\frac{c(C).c(D)}{c(A).{c}^{2}(B)}$;
(3)若700℃,反应达平衡时,A的浓度为0.55mol/L>0.4mol/L,说明降低温度平衡逆向移动;
(4)先计算浓度商,根据浓度商与化学平衡常数相对大小确定反应方向.
解答 解:(1)0~5min内,v(D)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.6-0}{1}}{5}$mol/(L.min)=0.12mol/(L.min),v(B)=2v(D)=2×0.12mol/(L.min)=0.24mol/(L.min),
故答案为:0.24mol/(L.min);
(2)开始时c(A)=1.0mol/L、c(B)=2.2mol/L,平衡时c(D)=0.6mol/L,
该反应中A(g)+2B(g)?C(g)+D(g),
开始(mol/L)1.0 2.2 0 0
反应(mol/L)0.6 1.2 0.6 0.6
平衡(mol/L)0.4 1.0 0.6 0.6
化学平衡常数K=$\frac{c(C).c(D)}{c(A).{c}^{2}(B)}$=$\frac{0.6×0.6}{0.4×1.{0}^{2}}$=0.9,
故答案为:0.9;
(3)若700℃,反应达平衡时,A的浓度为0.55mol/L>0.4mol/L,说明降低温度平衡逆向移动,则正反应是吸热反应,故答案为:吸热;
(4)浓度商=$\frac{0.20×0.018}{0.06×0.5{0}^{2}}$=0.24<0.9,浓度商小于平衡常数,平衡向正方向进行,
故答案为:向正方向进行.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析计算能力,明确化学平衡常数与温度关系、化学平衡常数计算方法是解本题关键,注意化学平衡常数的灵活运用,题目难度不大.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
| A. | X-胶体 Y-混合物 Z-淀粉溶液 | B. | X-化合物 Y-含氧酸盐 Z-氯化钠 | ||
| C. | X-气态氢化物 Y-酸 Z-盐酸 | D. | X-强电解质 Y-强酸 Z-硫酸 |
| A. | 常温下,pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4 | |
| B. | 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 | |
| C. | 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质 | |
| D. | 溶液中c(H+)越大,pH也越大,溶液的酸性就越强 |
 在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )| A. | 若b、c两点的平衡常数分别为K1、K2,则K1>K2 | |
| B. | a、b两点的反应速率:b>a | |
| C. | 为了提高Br2(g)的转化率可采取增加Br2(g)通入量的方法 | |
| D. | b、c两点的HBr的体积分数b>c |
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.
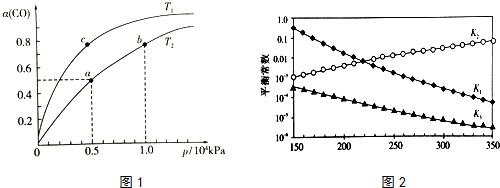
①a、b两点的反应速率:v(a)<v(b)(填“>”“<”或“=”).
②T1<T2(填“>”“<”或“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
Ⅰ:CO(g)+2H2(g)$\stackrel{催化剂}{?}$CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如图2所示.
则△H1<△H3(填“>”、“<”、“=”),理由是由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+
△H2,所以△H1<△H3..
| 实验内容 | 实验目的 | |
| A | 向某未知溶液中加人BaCl2溶液后,再加人稀硝酸观察沉淀的生成 | 检验是否含 SO42-离子 |
| B | 向某未知溶液中加人NaOH固体,加热,在管口用湿润的蓝色石蕊试纸检验 | 检验是否含NH4+离子 |
| C | 加热分别用SO2和HClO漂白后的品红溶液 | 探究SO2和HCIO漂白原理的不同 |
| D | 加热盛有浓硫酸和铜的试管 | 探究浓硫酸的脱水性 |
| A. | A | B. | B | C. | C | D. | D |


 ,反应类型为
,反应类型为