题目内容
11.铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4•7H2O)在医药上作为补血剂.某课外小组对该补血剂(每片b克)中铁元素的含量进行了测定.具体实验步骤如图所示: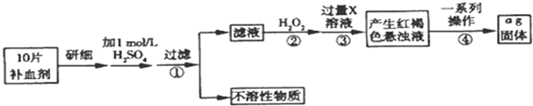
(1)在进行步骤①操作时,需要用到的主要玻璃仪器有漏斗、烧杯、玻璃棒.
(2)步骤②中H2O2的作用是使Fe2+完全被氧化(填“氧化”或“还原”)为Fe3+.
(3)若步骤③中X为氨水,请写出该步骤中产生红褐色物质时发生反应的离子方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+
(4)步骤④中一系列处理的操作步骤依次为过滤、洗涤、灼烧、冷却、称量.
(5)若实验过程中无损耗,则每片补血剂含铁元素的质量分数为$\frac{7a}{b}$%.
分析 由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)步骤①操作为过滤,需要用到的主要玻璃仪器有漏斗、烧杯、玻璃棒;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(5)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.
解答 解:(1)步骤①操作为过滤,需要用到的主要玻璃仪器有漏斗、烧杯、玻璃棒;故答案为:漏斗、烧杯、玻璃棒;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,
故答案为:氧化;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;洗涤;
(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量$\frac{ag×\frac{112}{160}}{10}$×100%=0.07ag,则每片补血剂含铁元素的质量分数为$\frac{0.07ag}{bg}$×100%=$\frac{7a}{b}$%,故答案为:$\frac{7a}{b}$%.
点评 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案| A. | 18 g H2O含有10NA个质子 | |
| B. | 7.8 g Na2O2中含有的阴离子数是0.2NA | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3<0Ⅰ
CO2(g)+H2(g)?CO(g)+H2O(g)△H2>0Ⅱ
催化剂A和催化剂B对这两个反应均具有催化能力.某实验室控制CO2和H2初始投料比为1:2.2.在相同压强下,经过相同反应时间测得如表实验数据:
| 实验编号 | T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 1 | 543 | 催化剂 A | 12.3 | 42.3 |
| 2 | 543 | 催化剂B | 10.9 | 72.7 |
| 3 | 553 | 催化剂 A | 15.3 | 39.1 |
| 4 | 553 | 催化剂B | 12.0 | 71.6 |
(1)测得实验数据时,反应不是(填“是”或“不是”)处于平衡态.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有CD.
A.使用催化剂AB.使用催化剂B
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明:在相同温度下,因为催化剂A和B对反应Ⅰ的催化能力不同,所以在该时刻不同的催化剂对CO2转化成CH3OH的选择性有显著的影响.
| A. | 氟利昂或NO2都可破坏臭氧层而导致“温室效应” | |
| B. | 蜂蚁蜇咬人的皮肤时,会将分泌物甲酸注入人体,使人感到疼痛难忍,涂抹稀氨水或者碳酸氢钠溶液可以减轻疼痛 | |
| C. | 向燃料煤中加入生石灰,可减少对大气的污染 | |
| D. | 热水瓶中的水垢的主要成分是CaCO3和Mg(OH)2 |
| A. | 0.57 mol | B. | 2.25mol | C. | 2 mol | D. | 0.63mol |

 含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感.
含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感.