题目内容
 科学家合成了一系列独特的氢铝化合物.最简单的氢铝化合物化学式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )
科学家合成了一系列独特的氢铝化合物.最简单的氢铝化合物化学式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )| A、Al2H6中Al为-3价,H为+l价 |
| B、Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| C、Al2H6是共价化合物 |
| D、氢铝化合物可能成为未来的储氢材料和火箭燃料 |
考点:镁、铝的重要化合物,根据化学式判断化合价,共价键的形成及共价键的主要类型
专题:
分析:A.根据元素的电负性和铝的化合价判断;
B.根据元素守恒分析;
C.根据Al2H6分子的球棍模型分析;
D.根据氢铝化合物的性质分析.
B.根据元素守恒分析;
C.根据Al2H6分子的球棍模型分析;
D.根据氢铝化合物的性质分析.
解答:
解:A.在化合物中电负性大的显负价,电负性小的元素显正价,氢元素的电负性大于铝元素,氢铝化合物中铝元素显+3价,氢元素显-1价,故A错误;
B.根据题中信息Al2H6的燃烧热极高,判断Al2H6能燃烧,根据原子守恒,Al2H6的组成元素只有Al、H两种元素,又由于是在氧气中燃烧,推出燃烧产物为氧化铝和水,故B正确;
C.根据Al2H6分子的球棍模型可知,该分子为共价化合物,故C正确;
D.氢铝化合物能和水反应生成氢氧化铝和氢气,可以作储氢材料,燃烧热极高可以作火箭燃料,故D正确.
故选A.
B.根据题中信息Al2H6的燃烧热极高,判断Al2H6能燃烧,根据原子守恒,Al2H6的组成元素只有Al、H两种元素,又由于是在氧气中燃烧,推出燃烧产物为氧化铝和水,故B正确;
C.根据Al2H6分子的球棍模型可知,该分子为共价化合物,故C正确;
D.氢铝化合物能和水反应生成氢氧化铝和氢气,可以作储氢材料,燃烧热极高可以作火箭燃料,故D正确.
故选A.
点评:本题以铝的化合物为载体考查铝的化合物的性质,根据元素电负性、元素化合价和性质的关系来分析解答即可,侧重于考查学生对题目信息的提取和应用能力,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
实验室里制备Al(OH)3的方法最好的是( )
| A、在NaAlO2溶液中加入过量盐酸溶液 |
| B、在AlCl3溶液中加入过量氨水 |
| C、在AlCl3溶液中加入过量NaOH溶液 |
| D、用Al2O3与水反应 |
制备乙酸乙酯的绿色合成路线之一为:
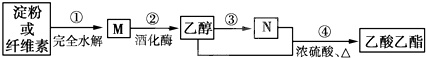
下列说法不正确的是( )

下列说法不正确的是( )
| A、M的分子式为C6H12O6 |
| B、用NaOH溶液可除去乙酸乙酯中混有的乙酸 |
| C、①、④的反应类型均属于取代反应 |
| D、N的化学式为CH3COOH |
X、Y、Z分别是短周期元素的三种单质,它们都是常见的金属或非金属.M、N、R是常见的三种氧化物.其中一种具有高熔点,而且有如下反应(条件未标出,方程未配平)若X是非金属,则组成Y单质的元素在周期表中的位置是( )
(1)X+Z→N; (2)M+X→N; (3)M+Y→R+X.
(1)X+Z→N; (2)M+X→N; (3)M+Y→R+X.
| A、第二周期ⅣA族 |
| B、第二周期ⅥA族 |
| C、第三周期ⅡA族 |
| D、第三周期ⅣA族 |
下列叙述正确的是( )
| A、加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32- |
| B、用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是排除SO42-以外的其它阴离子及Ag+的干扰 |
| C、做焰色反应实验时,应先将铂丝(或铁丝)用稀硫酸洗净后,在酒精灯外焰上灼烧至没有颜色时,再蘸取待测溶液进行实验 |
| D、验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含Cl- |
下列说法正确的是( )
| A、容量瓶、烧杯、量筒使用前均需要验漏、洗净并烘干 |
| B、分液时,需先打开分液漏斗上端的玻璃塞,再将下层液体从下口放出 |
| C、将硫酸铜溶液蒸发至有大量固体析出时,停止加热,便可得到胆矾晶体 |
| D、配制一定物质的量浓度溶液时,当容量瓶中液面高于刻度线时,用胶头滴管吸出少量液体即可 |
 ①若某金属M为第四周期单电子数最多的元素,该元素在周期表中的位置
①若某金属M为第四周期单电子数最多的元素,该元素在周期表中的位置