题目内容
 ①若某金属M为第四周期单电子数最多的元素,该元素在周期表中的位置
①若某金属M为第四周期单电子数最多的元素,该元素在周期表中的位置②在MCl3的水溶液中,一定条件下存在组成为[MCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[MCln(H2O)6-n]x++xR-H→Rx[MCln(H2O)6-n]+xH+
交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成.将含0.0015mol[MCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200mol/L NaOH溶液25.00mL,可知该配离子的化学式为
考点:晶胞的计算,配合物的成键情况
专题:
分析:①第四周期单电子数最多的元素是Cr,其电子排布式为1s22s22p63s23p63d54s1,共有6个未成对电子;
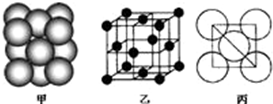
以顶点的原子为例,该原子的配位数=3×8×
=12,该晶胞构型为面心立方;
②由中和生成的H+需要的NaOH溶液,可得出H+物质的量,进而计算出x,再结合Cr的化合价+3价,求n;
利用离子交换反应计算出配离子的电荷数,再判断中心离子的配位数.
以顶点的原子为例,该原子的配位数=3×8×
| 1 |
| 2 |
②由中和生成的H+需要的NaOH溶液,可得出H+物质的量,进而计算出x,再结合Cr的化合价+3价,求n;
利用离子交换反应计算出配离子的电荷数,再判断中心离子的配位数.
解答:
解:①第四周期单电子数最多的元素是Cr,其电子排布式为1s22s22p63s23p63d54s1,共有6个未成对电子,Cr元素在周期表中的位置是第四周期VIB族;
以顶点的原子为例,和顶点原子距离最近的原子是相邻的三个面心上原子,所以该原子的配位数=3×8×
=12,该晶胞构型为面心立方,属于铜型,或者面心立方最密堆积;
故答案为:第四周期VIB族;12;面心立方最密堆积;
②中和生成的H+需浓度为0.1200mol/L氢氧化钠溶液25.00mL,则可以得出H+的物质的量为0.12nol/L×25.00×10-3L=0.0030mol,所以x=
=2,Cr的化合价为+3价,结合[CrCln(H20)6-n]x+,有3-n=2,可以得知n=1,即该配离子的化学式为[CrCl(H2O)5]2+;
中心离子为氯离子,配体是Cr和H20,所以中心离子配位数是1+5=6,
故答案为:[CrCl(H2O)5]2+;6.
以顶点的原子为例,和顶点原子距离最近的原子是相邻的三个面心上原子,所以该原子的配位数=3×8×
| 1 |
| 2 |
故答案为:第四周期VIB族;12;面心立方最密堆积;
②中和生成的H+需浓度为0.1200mol/L氢氧化钠溶液25.00mL,则可以得出H+的物质的量为0.12nol/L×25.00×10-3L=0.0030mol,所以x=
| 0.0030 |
| 0.0015 |
中心离子为氯离子,配体是Cr和H20,所以中心离子配位数是1+5=6,
故答案为:[CrCl(H2O)5]2+;6.
点评:本题考查了晶胞的有关计算、配位数的确定、晶体中原子堆积方式等知识点,注意对基础知识的理解掌握,整体把握元素周期表,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
FeCl3溶液和Fe(OH)3胶体具有的共同性质是( )
| A、滴入盐酸,先产生沉淀,然后沉淀又溶解 |
| B、都能透过半透膜 |
| C、都有丁达尔现象 |
| D、都是均一的分散系 |
下列有关物质性质、应用的说法中不正确的是( )
| A、Al2O3既能溶于NaOH溶液又能溶于HCl,说明Al2O3是两性氧化物 |
| B、浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性 |
| C、SO2气体具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 |
| D、石英的主要成分是SiO2 |
短周期主族元素A、B形成AB3型分子,下列有关叙述正确的是( )
| A、若A、B为同一周期元素,则AB3分子一定为平面正三角形 |
| B、若AB3分子中的价电子个数为24个,则AB3分子为平面正三角形 |
| C、若为A、B为同一主族元素,则AB3分子一定为三角锥形 |
| D、若AB3分子为三角锥形,则AB3分子一定为NH3 |
 科学家合成了一系列独特的氢铝化合物.最简单的氢铝化合物化学式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )
科学家合成了一系列独特的氢铝化合物.最简单的氢铝化合物化学式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )| A、Al2H6中Al为-3价,H为+l价 |
| B、Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| C、Al2H6是共价化合物 |
| D、氢铝化合物可能成为未来的储氢材料和火箭燃料 |
有机物甲能发生银镜反应,甲催化加氢还原成有机物乙,1mol乙跟足量的金属钠反应放出(标准状况下)氢气22.4L,据此推断乙可能是( )
| A、CH3CHOHCHOHCH3 |
| B、HOCH2CHOHCH3 |
| C、CH3CH2CH2OH |
| D、CH3CHOHCH3 |
 如图中A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3溶液发生反应,C和D的相对分子质量相等,且E为无支链的化合物.请回答下列问题:
如图中A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3溶液发生反应,C和D的相对分子质量相等,且E为无支链的化合物.请回答下列问题: