题目内容
16.下列说法不正确的是( )| A. | CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧热的热化学方程式为:CO (g)+$\frac{1}{2}$O2(g)═CO2 (g);△H=-283.0 kJ•mol-1 | |
| B. | 稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ•mol-1,则表示稀硫酸与稀氢氧化钾溶液中和热的热化学方程式为:$\frac{1}{2}$H2SO4(l)+KOH(l)═$\frac{1}{2}$K2SO4(l)+H2O(l);△H=-57.3 kJ•mol-1 | |
| C. | 已知H-H键键能为436 kJ•mol-1,H-N键键能为391 kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1,则N≡N键的键能约为946kJ•mol-1 | |
| D. | 一定条件下,反应2CO(g)═CO2(g)+C(s)可自发进行,则该反应的△H<0 |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
B、物质的状态错误,溶液中的反应应标为“aq”;
C、反应热=反应物的总键能-生成物的总键能,以此解答;
D、△H-T△S<0反应自发进行,反应2CO(g)═CO2(g)+C(s),△S<0,据此回答.
解答 解:A、燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,表示CO(g)燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ/mol,故A正确;
B、表示稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+KOH(aq)=$\frac{1}{2}$K2SO2(aq)+H2O(l);△H=-57.3KJ/mol,故B错误;
C、已知:H-H键能为436kJ/mol,H-N键能为391kJ/mol,令N≡N的键能为x,对于反应N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,反应热=反应物的总键能-生成物的总键能,故x+3×436kJ/mol-2×3×391kJ/mol=-92.4kJ/mol,解得:x=946 kJ/mol,故C正确;
D、△H-T△S<0,反应自发进行,反应△S<0,满足△H-T△S<0,则△H<0,故D正确;
故选B.
点评 本题考查了中和热、燃烧热概念的理解的判断,化学反应的能量变化特征应用,反应条件的分析判断,题目难度中等.

练习册系列答案
相关题目
6.下列做法存在安全隐患的是( )
①将水沿烧杯内壁加入浓硫酸中,并不断搅拌
②实验室制取O2时,先撤导气管再撤酒精灯
③取用金属钠或钾做完实验后,将剩余药品放回原瓶
④夜间煤气发生泄漏时,应立即开灯检查煤气泄漏的原因,然后打开所有的门窗通风
⑤油锅起火可用水灭火.
①将水沿烧杯内壁加入浓硫酸中,并不断搅拌
②实验室制取O2时,先撤导气管再撤酒精灯
③取用金属钠或钾做完实验后,将剩余药品放回原瓶
④夜间煤气发生泄漏时,应立即开灯检查煤气泄漏的原因,然后打开所有的门窗通风
⑤油锅起火可用水灭火.
| A. | ①④⑤ | B. | ①②③④ | C. | ①②③④⑤ | D. | 全部 |
4.下列物质不可能通过化合反应得到的是( )
| A. | Al2S3 | B. | FeCl2 | C. | Fe(OH)3 | D. | H2SiO3 |
11.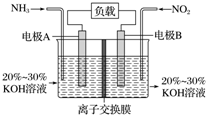 利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
 利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )| A. | 电子从右侧电极经过负载后流向左侧电极 | |
| B. | 为使电池持续放电,离子交换膜需选用阴离子交换膜 | |
| C. | 电极A极反应式为2NH3-6e-+6OH-═N2+6H2O | |
| D. | 当有4.48 L NH3 (标准状况)反应时,转移电子为0.6 mol |
8.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
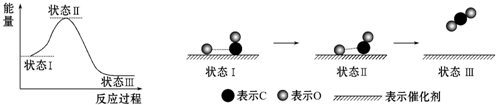
下列说法正确的是( )

下列说法正确的是( )
| A. | CO和O生成CO2是吸热反应 | |
| B. | 在该过程中,CO断键形成C和O | |
| C. | 状态Ⅰ→状态Ⅲ表示CO和O反应生成CO2的过程 | |
| D. | 状态Ⅰ→状态Ⅲ表示CO与O2反应生成CO2的过程 |
6.下列物质中,属于强电解质的是( )
| A. | NH4Cl | B. | HCOOH | C. | NH3•H2O | D. | Al(OH)3 |