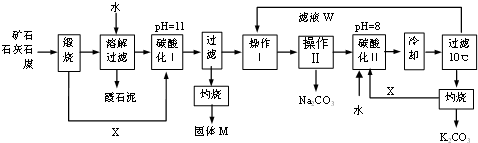
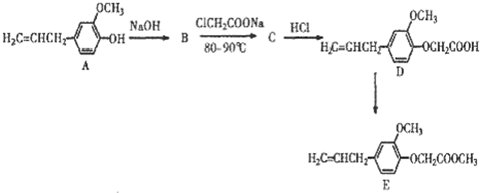
题目内容
对于平衡体系:mX(g)+nY(g)?pZ(g)△H<0.下列判断不正确的是( )
| A、若m+n<p,温度不变,将容器体积缩小到原来的一半,则X的浓度大于原来的2倍 |
| B、若在密闭恒温容器中加入pmol的Z达到平衡,再加入一定量的Z,Z的百分比含量不变,则m+n=p |
C、若定温下Y的体积分数(Y%)与压强变化的关系如图所示,则a点表示平衡正向移动且反应速率:a点<b点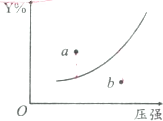 |
| D、若m+n=p,且在密闭恒容容器内进行,当温度升高时,平衡逆向移动,容器中气体的压强不变 |
考点:化学平衡的影响因素
专题:
分析:A.若m+n<p,温度不变,将容器体积缩小到原来的一半,增大压强,平衡向气体体积减小的方向移动;
B.若在密闭恒温容器中加入pmol的Z达到平衡,再加入一定量的Z,Z的百分比含量不变,说明两次反应中Z的转化率相等,则反应前后气体计量数之和相等;
C.要使反应a点达到平衡状态,则该反应应该向正反应方向移动;压强越大反应速率越大;
D.若m+n=p,且在密闭恒容容器内进行,当温度升高时,平衡逆向移动,但混合气体的物质的量不变.
B.若在密闭恒温容器中加入pmol的Z达到平衡,再加入一定量的Z,Z的百分比含量不变,说明两次反应中Z的转化率相等,则反应前后气体计量数之和相等;
C.要使反应a点达到平衡状态,则该反应应该向正反应方向移动;压强越大反应速率越大;
D.若m+n=p,且在密闭恒容容器内进行,当温度升高时,平衡逆向移动,但混合气体的物质的量不变.
解答:
解:A.若m+n<p,温度不变,将容器体积缩小到原来的一半,增大压强,平衡向气体体积减小的方向正反应方向移动,所以X的浓度小于原来的2倍,故A错误;
B.若在密闭恒温容器中加入pmol的Z达到平衡,再加入一定量的Z,Z的百分比含量不变,说明两次反应中Z的转化率相等,则反应前后气体计量数之和相等,即m+n=p,故B正确;
C.要使反应a点达到平衡状态,则该反应应该向正反应方向移动,所以正反应速率大于逆反应速率;压强越大反应速率越大,所以反应速率a点<b点,故C正确;
D.若m+n=p,且在密闭恒容容器内进行,当温度升高时,平衡逆向移动,但混合气体的物质的量不变,所以容器中气体的压强不变,故D正确;
故选A.
B.若在密闭恒温容器中加入pmol的Z达到平衡,再加入一定量的Z,Z的百分比含量不变,说明两次反应中Z的转化率相等,则反应前后气体计量数之和相等,即m+n=p,故B正确;
C.要使反应a点达到平衡状态,则该反应应该向正反应方向移动,所以正反应速率大于逆反应速率;压强越大反应速率越大,所以反应速率a点<b点,故C正确;
D.若m+n=p,且在密闭恒容容器内进行,当温度升高时,平衡逆向移动,但混合气体的物质的量不变,所以容器中气体的压强不变,故D正确;
故选A.
点评:本题考查化学平衡影响因素,侧重考查分析能力,根据外界条件对平衡的影响分析,易错选项是B,正确构建等效平衡是解本题关键,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、20℃101kPa时,气体摩尔体积约为22.4L/mol |
| B、阿伏加德罗常数只是一个数,没有单位 |
| C、摩尔是七个基本物理量之一 |
| D、在温度、压强一定时,任何具有相同微粒数的气体都具有大致相同的体积 |
用NA表示阿伏加德罗常数,下列物质中所含分子数目最多的是( )
| A、含NA个分子的氮气 |
| B、标准状况下3.36L甲烷 |
| C、5.4 g水(水的摩尔质量为18g?mol-1) |
| D、0.4mol三氧化硫 |
下列溶液中离子浓度的关系一定正确的是( )
| A、NH4Cl溶液中:c(Cl-)+c(H+)=c(NH4+)+c(OH-)+2c(NH3.H2O) |
| B、Na2CO3和NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| C、等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:2c(K+)=c(X-)+c(HX)+c(H+) |
| D、pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:c(M+)=c(X-)>c(H+)=c(OH-) |
下列说法正确的是( )
| A、s能级的能量总是小于p能级的能量 |
| B、2s的电子云比1s的电子云大,说明2s的电子云中的电子比1s的多 |
| C、当电子排布在同一能级的不同轨道时,电子总是先占满1个轨道,然后再占据其他原子轨道 |
| D、nf能级中最多可容纳14个电子 |