题目内容
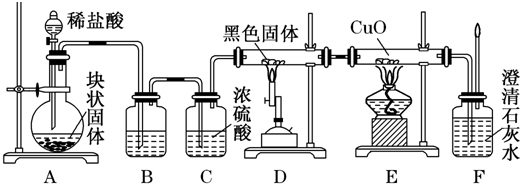
选用如下实验装置组合后完成用浓盐酸、二氧化锰共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉的实验.已知①工业制漂白粉反应为放热反应.②温度稍高即发生副反应6Cl2+6Ca(OH)2═5CaCl2+Ca(ClO3)2+6H2O.
(1)选用各装置的接口顺序为 (填图中小写英文字母).
(2)制漂白粉的装置选择 填C或D)装置的原因 F装置的作用是 写出F中发生反应的化学方程式
(3)实验中若用12mol﹒L-1的浓盐酸100mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是小于0.15mol,其可能的主要原因是 (假定各步反应均无反应物损耗且无副反应发生).

(1)选用各装置的接口顺序为
(2)制漂白粉的装置选择
(3)实验中若用12mol﹒L-1的浓盐酸100mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是小于0.15mol,其可能的主要原因是
考点:氯气的实验室制法
专题:
分析:(1)根据制取氯气的反应原理及题干信息判断反应装置,然后连接装置的接口;
(2)根据题干信息“①工业制漂白粉反应为放热反应.②温度稍高即发生副反应6Cl2+6Ca(OH)2═5CaCl2+Ca(ClO3)2+6H2O”进行判断;氯气有毒,选用使用尾气吸收装置,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(3)稀盐酸与MnO2不反应,浓盐酸逐渐变稀,且浓盐酸易挥发,盐酸不能全部反应生成Cl2.
(2)根据题干信息“①工业制漂白粉反应为放热反应.②温度稍高即发生副反应6Cl2+6Ca(OH)2═5CaCl2+Ca(ClO3)2+6H2O”进行判断;氯气有毒,选用使用尾气吸收装置,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(3)稀盐酸与MnO2不反应,浓盐酸逐渐变稀,且浓盐酸易挥发,盐酸不能全部反应生成Cl2.
解答:
解:(1)制取Cl2的方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,分液漏斗可以控制加入的浓盐酸,所以制取氯气的装置应该选用装置A;依据题给信息Cl2与Ca(OH)2的反应是放热反应,且温度高时易发生副反应,所以制漂白粉时应采取降温措施,故应该选用D来制取漂白粉;Cl2有毒,需进行尾气处理,应该选用装置F吸收多余的氯气,所以装置连接顺序为:adig,
故答案为:adig;
(2)Cl2与Ca(OH)2的反应是放热反应,且温度高时易发生副反应,所以制漂白粉时应采取降温措施,故应该选用D来制取漂白粉;
氯气是有毒气体,多余的氯气需要用氢氧化钠溶液吸收,避免污染大气;氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:D;该反应放热,温度升高,有副反应发生;吸收氯气,防止污染大气;Cl2+2OH-=Cl-+ClO-+H2O;
(3)12mol﹒L-1的浓盐酸100mL,含有氯化氢的物质的量为:12mol/L×0.1L=1.2mol,根据反应方程式MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O可知,1.2mol氯化氢完全反应生成0.4mol氯气,再根据反应2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O可知理论上0.4mol氯气完全反应可以生成0.2mol次氯酸钙;但是随着反应的进行,浓盐酸逐渐变稀,稀盐酸与MnO2不反应,且浓盐酸易挥发,所以盐酸不能全部反应生成Cl2,故生成的Ca(ClO)2小于0.15mol,
故答案为:浓盐酸反应后浓度变稀,反应停止.
| ||
故答案为:adig;
(2)Cl2与Ca(OH)2的反应是放热反应,且温度高时易发生副反应,所以制漂白粉时应采取降温措施,故应该选用D来制取漂白粉;
氯气是有毒气体,多余的氯气需要用氢氧化钠溶液吸收,避免污染大气;氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:D;该反应放热,温度升高,有副反应发生;吸收氯气,防止污染大气;Cl2+2OH-=Cl-+ClO-+H2O;
(3)12mol﹒L-1的浓盐酸100mL,含有氯化氢的物质的量为:12mol/L×0.1L=1.2mol,根据反应方程式MnO2+4HCl(浓)
| ||
故答案为:浓盐酸反应后浓度变稀,反应停止.
点评:本题考查了氯气的制法及化学性质,题目难度中等,试题综合性较强,既要熟悉Cl2的制法,又要抓住题给信息应用理论知识,采取相应的实验措施,试题充分考查了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
下列各组物质中,因为反应条件或用量不同而发生不同化学反应的是( )
①C与O2 ②Na与O2 ③Fe与Cl2 ④AlCl3溶液与NaOH溶液⑤CO2与NaOH溶液 ⑥Cu与硝酸.
①C与O2 ②Na与O2 ③Fe与Cl2 ④AlCl3溶液与NaOH溶液⑤CO2与NaOH溶液 ⑥Cu与硝酸.
| A、除③外 | B、除③⑤外 |
| C、除③④外 | D、除⑥外 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | ||
| B、由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO3-、K+ | ||
C、
| ||
| D、c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、HCO3- |