题目内容
已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的△H 0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率会 (填“变大”、“变小”或“不变”)
(3)若保持容器的容积不变,则该反应达到化学平衡状态的依据是 (填序号).
a.单位时间里生成B和D的物质的量相等
b.气体的密度不随时间改变
c.容器内压强保持不变
d.混合气体的平均摩尔质量保持不变
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为 .
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的△H
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,若反应经一段时间后,达到平衡时A的转化率为
(3)若保持容器的容积不变,则该反应达到化学平衡状态的依据是
a.单位时间里生成B和D的物质的量相等
b.气体的密度不随时间改变
c.容器内压强保持不变
d.混合气体的平均摩尔质量保持不变
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为
考点:化学平衡的计算,化学平衡状态的判断
专题:
分析:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应;
(2)设平衡时A的浓度变化量为x,利用三段式表示平衡时各组分的平衡浓度,代入平衡常数列方程计算x的值,再根据转化率定义计算;
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数.
由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应;
(2)设平衡时A的浓度变化量为x,利用三段式表示平衡时各组分的平衡浓度,代入平衡常数列方程计算x的值,再根据转化率定义计算;
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数.
解答:
解:(1)由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0,故答案为:<;
(2)反应初始6s内A的平均反应速率v(A)=0.003mol?L-1?s-1,则6s内△c(A)=0.003mol?L-1?s-1×6s=0.018mol/L,A的起始浓度为
=0.04mol/L,故6s时时c(A)=0.04mol/L-0.018mol/L=0.022mol/L,故6s内△n(A)=0.018mol/L×5L=0.09mol,由方程式可知n(C)=△n(A)=0.09mol,
设平衡时A的浓度变化量为x,则:
A(g)+B(g)?C(g)+D(g)
开始(mol/L):0.04 0.16 0 0
变化(mol/L):x x x x
平衡(mol/L):0.04-x 0.16-x x x
故
=1,解得x=0.032
所以平衡时A的转化率为
×100%=80%,
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变,
故答案为:80%;不变;
(3)a.单位时间里生成B和D的物质的量相等,说明单位时间内生成的物质的量与消耗B的物质的量相等,说明到达平衡,故a正确;
b.混合气体的总质量不变,容器的容积不变,故混合气体的密度始终不变,故气体的密度不随时间改变,不能说明到达平衡,故b错误,
c.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,故c错误,
d.混合气体的总质量不变,容器的容积不变,物质的量不变,混合气体的平均摩尔质量保持不变,不能说明到达平衡,故d错误,
故答案为:a;
(4)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数,故1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为
=2.5,
故答案为:2.5.
(2)反应初始6s内A的平均反应速率v(A)=0.003mol?L-1?s-1,则6s内△c(A)=0.003mol?L-1?s-1×6s=0.018mol/L,A的起始浓度为
| 0.2mol |
| 5L |
设平衡时A的浓度变化量为x,则:
A(g)+B(g)?C(g)+D(g)
开始(mol/L):0.04 0.16 0 0
变化(mol/L):x x x x
平衡(mol/L):0.04-x 0.16-x x x
故
| x2 |
| (0.04-x)(0.16-x) |
所以平衡时A的转化率为
| 0.032mol/L |
| 0.04mol/L |
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变,
故答案为:80%;不变;
(3)a.单位时间里生成B和D的物质的量相等,说明单位时间内生成的物质的量与消耗B的物质的量相等,说明到达平衡,故a正确;
b.混合气体的总质量不变,容器的容积不变,故混合气体的密度始终不变,故气体的密度不随时间改变,不能说明到达平衡,故b错误,
c.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,故c错误,
d.混合气体的总质量不变,容器的容积不变,物质的量不变,混合气体的平均摩尔质量保持不变,不能说明到达平衡,故d错误,
故答案为:a;
(4)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数,故1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为
| 1 |
| 0.4 |
故答案为:2.5.
点评:本题考查化学平衡计算、平衡常数计算、化学反应速率、平衡状态判断,难度中等,注意化学平衡状态判断,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
粗盐中含有不溶性的泥沙和可溶性的Ca2+、Mg2+、SO42-等杂质,除去SO42-用加入什么试剂( )
| A、稀HCl |
| B、BaCl2 溶液 |
| C、AgNO3溶液 |
| D、稀HNO3 |
下列物质在水溶液中的电离方程式正确的是( )
| A、Na2CO3=Na22++CO32- |
| B、NaHSO4=Na++H++SO42- |
| C、CH3COOH=H++CH3COO- |
| D、H2CO3=2H++CO32- |
 下列说法中正确的是( )
下列说法中正确的是( )| A、Na2S2O3+2HCl?2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 |
| B、若在恒容容器中发生反应:N2+3H2?2NH3,达到平衡后再充入适量NH3,由于压强增大,化学平衡向正反应方向移动 |
| C、在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率-时间图象可用图一表示 |
| D、若在恒压容器中发生反应:2SO3?2SO2+O2,达到平衡后再充入适量He,其速率-时间图象可用图二表示 |
下列溶液中各微粒的浓度关系正确的是( )
| A、0.1mol?L-1HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| B、0.1mol?L-1NaHCO3溶液中:c(Na+)+c(H+)十c(H2CO3)=c(HCO3-)+2c(CO32-) |
| C、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
| D、等物质的量浓度的硫酸与醋酸钠溶液等体积混合:2c(SO42-)+c(OH-)=c(H+)+c(CH3COOH) |
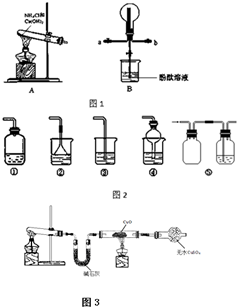 某化学实验小组同学利用如图1所示装置制备氨气,并探究氨气的性质(部分仪器已略去).
某化学实验小组同学利用如图1所示装置制备氨气,并探究氨气的性质(部分仪器已略去).