题目内容
Na、Cu、O、Si、S、Cl是常见的六种元素.
(1)Na位于元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;
Si的基态原子核外电子排布式为 .
(2)用“>”或“<”填空:
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取.写出该反应的离子方程式 ,并标出电子转移的方向和数目.
(1)Na位于元素周期表第
Si的基态原子核外电子排布式为
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si | O2-Na+ | NaCl | H2SO4 |
考点:原子核外电子排布,离子方程式的书写,微粒半径大小的比较,元素电离能、电负性的含义及应用,晶体的类型与物质熔点、硬度、导电性等的关系
专题:
分析:(1)Na元素位于元素周期表第三周期 第IA族;S的基态原子核外未成对电子处于3p轨道;Si原子核外电子基态排布式为1s22s22p63s23p2;
(2)同一周期元素的第一电离能随着原子序数的增大而增大;
核外电子排布相同的离子,核电荷数越大,离子半径越小;
一般来说,原子晶体(Si)的熔点高于离子晶体(NaCl)的熔点;
元素的非金属性越强,元素最高价氧化物的水化物的酸性越强;
(3)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子.
(2)同一周期元素的第一电离能随着原子序数的增大而增大;
核外电子排布相同的离子,核电荷数越大,离子半径越小;
一般来说,原子晶体(Si)的熔点高于离子晶体(NaCl)的熔点;
元素的非金属性越强,元素最高价氧化物的水化物的酸性越强;
(3)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子.
解答:
解:(1)Na元素位于元素周期表第三周期 第IA族;S的基态原子核外未成对电子处于3p轨道,共2个未成对电子,Si原子核外电子数为14,核外电子基态排布式为1s22s22p63s23p2;故答案为:三;IA;2;1s22s22p63s23p2;
(2)同一周期元素,随着原子序数的增加,原子核对核外电子的吸引力增强,第一电离能增大,增大而增大,所以第一电离能:S>Si;核外电子排布相同的离子,核电荷数越大,离子半径越小,所以离子半径:O2->Na+;一般来说,原子晶体(Si)的熔点高于离子晶体(NaCl)的熔点,故熔点:Si>NaCl;元素的非金属性越强,元素最高价氧化物的水化物的酸性越强,因为非金属性Cl>S,所以酸性:HClO4>H2SO4;
故答案为:<;>;<;<;
(3)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子,因此离子方程式、电子转移的方向和数目表示为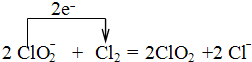 ,
,
故答案为: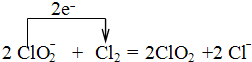 .
.
(2)同一周期元素,随着原子序数的增加,原子核对核外电子的吸引力增强,第一电离能增大,增大而增大,所以第一电离能:S>Si;核外电子排布相同的离子,核电荷数越大,离子半径越小,所以离子半径:O2->Na+;一般来说,原子晶体(Si)的熔点高于离子晶体(NaCl)的熔点,故熔点:Si>NaCl;元素的非金属性越强,元素最高价氧化物的水化物的酸性越强,因为非金属性Cl>S,所以酸性:HClO4>H2SO4;
故答案为:<;>;<;<;
(3)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子,因此离子方程式、电子转移的方向和数目表示为
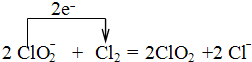 ,
,故答案为:
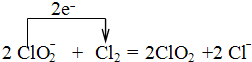 .
.
点评:本题考查知识点较多,涉及原子结构和元素周期律、反应热的计算、离子方程式书写和氧化还原反转移电子数的计算和表示方法,为高考常见题型,侧重于学生计算能力、分析比较能力的培养.

练习册系列答案
相关题目
在强碱性溶液中能大量共存,且溶液为无色透明的离子组是( )
| A、K+、MnO4-、Cl-、Ba2+ |
| B、Na+、Ba2+、HCO3-、NO3- |
| C、K+、NO3-、CO32-、Cl- |
| D、Na+、H+、Cl-、S2- |
 下列说法中正确的是( )
下列说法中正确的是( )| A、Na2S2O3+2HCl?2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 |
| B、若在恒容容器中发生反应:N2+3H2?2NH3,达到平衡后再充入适量NH3,由于压强增大,化学平衡向正反应方向移动 |
| C、在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率-时间图象可用图一表示 |
| D、若在恒压容器中发生反应:2SO3?2SO2+O2,达到平衡后再充入适量He,其速率-时间图象可用图二表示 |
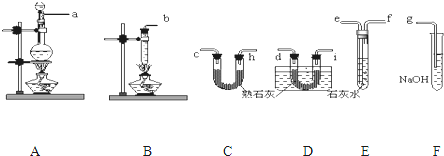

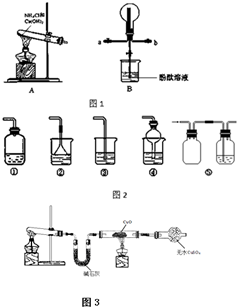 某化学实验小组同学利用如图1所示装置制备氨气,并探究氨气的性质(部分仪器已略去).
某化学实验小组同学利用如图1所示装置制备氨气,并探究氨气的性质(部分仪器已略去).