题目内容
某课外兴趣小组对H2O2的分解速率做了如下实验探究.下表是该小组研究影响过氧化氢分解速率的因素时采集的一组数据:用10mL H2O2制取150mL O2所需的时间(秒)
(1)该研究小组在设计方案时,考虑了浓度、 、 等因素对过氧化氢分解速率的影响;
(2)若已知1 克液态过氧化氢分解成氧气和液态水时,可放出2.89kJ能量,写出该反应的热化学方程式: ;
(3)产生的O2充入某密闭容器,发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g),不同情况测得反应速率,其中反应速率最快的是
A.υ(NH3)=0.4mol/(L?s) B.υ(O2)=0.5mol/(L?s)
C.υ(NO)=0.6mol/(L?s) D.υ(H2O)=1mol/(L?min)
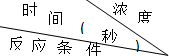 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
(2)若已知1 克液态过氧化氢分解成氧气和液态水时,可放出2.89kJ能量,写出该反应的热化学方程式:
(3)产生的O2充入某密闭容器,发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g),不同情况测得反应速率,其中反应速率最快的是
A.υ(NH3)=0.4mol/(L?s) B.υ(O2)=0.5mol/(L?s)
C.υ(NO)=0.6mol/(L?s) D.υ(H2O)=1mol/(L?min)
考点:探究影响化学反应速率的因素
专题:实验设计题
分析:(1)过氧化氢溶液是实验室制取氧气的重要药品,在常温下很难分解得到氧气,其分解速度受浓度、温度、催化剂等因素的影响设计实验方案来证明时,要注意实验的控制变量,以确保实验结果的准确性;
(2)根据热化学方程式的意义以及热化学方程式的书写方法来回答;
(3)利用速率之比等于化学计量数之比转化为同一物质表示的速率,据此进行比较.
(2)根据热化学方程式的意义以及热化学方程式的书写方法来回答;
(3)利用速率之比等于化学计量数之比转化为同一物质表示的速率,据此进行比较.
解答:
解:(1)根据表中给出的数据,无催化剂不加热的情况下,不同浓度的过氧化氢溶液都是几乎不反应,在无催化剂加热的情况下,不同浓度的过氧化氢溶液都分解,说明过氧化氢的分解速率与温度有关,但是得到相同气体的时间不同,浓度越大,反应的速度越快,说明过氧化氢的分解速率与浓度有关;比较同一浓度的过氧化氢溶液如30%时,在无催化剂加热的时候,需要时间是360s,有催化剂加热的条件下,需要时间是10s,说明过氧化氢的分解速率与温度、催化剂有关,故答案为:温度、催化剂;
(2)已知1克液态过氧化氢分解成氧气和液态水时,可放出2.89kJ能量,则68g即2mol液态过氧化氢分解成氧气和液态水时,可放出196.52kJ能量,即2H2O2(l)=2H2O(l)+O2(g);△H=-196.52 kJ?mol-1,故答案为:2H2O2(l)=2H2O(l)+O2(g);△H=-196.52 kJ?mol-1;
(3)4NH3(g)+5O2(g)?4NO(g)+6H2O(g),都表示为H2O的反应速率进行比较,
A.υ(NH3)=0.4mol/(L?s),速率之比等于化学计量数之比,故v(H2O)=0.6mol/(L?s),
B.υ(O2)=0.5mol/(L?s),速率之比等于化学计量数之比,故v(H2O)=0.6mol/(L?s),
C.υ(NO)=0.6mol/(L?s),速率之比等于化学计量数之比,故v(H2O)=0.9mol/(L?s),
D.υ(H2O)=1mol/(L?min)≈0.02mol/(L?s),故C表示的速率最快,
故选C.
(2)已知1克液态过氧化氢分解成氧气和液态水时,可放出2.89kJ能量,则68g即2mol液态过氧化氢分解成氧气和液态水时,可放出196.52kJ能量,即2H2O2(l)=2H2O(l)+O2(g);△H=-196.52 kJ?mol-1,故答案为:2H2O2(l)=2H2O(l)+O2(g);△H=-196.52 kJ?mol-1;
(3)4NH3(g)+5O2(g)?4NO(g)+6H2O(g),都表示为H2O的反应速率进行比较,
A.υ(NH3)=0.4mol/(L?s),速率之比等于化学计量数之比,故v(H2O)=0.6mol/(L?s),
B.υ(O2)=0.5mol/(L?s),速率之比等于化学计量数之比,故v(H2O)=0.6mol/(L?s),
C.υ(NO)=0.6mol/(L?s),速率之比等于化学计量数之比,故v(H2O)=0.9mol/(L?s),
D.υ(H2O)=1mol/(L?min)≈0.02mol/(L?s),故C表示的速率最快,
故选C.
点评:本题通过图表数据,考查了外界条件对反应速率的影响、反应速率的计算、热化学方程式的书写等知识,难度中等,要注意分析其他条件相同,只有一个条件改变时,如何影响反应速率.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目

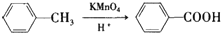
 (苯胺,易被氧化)
(苯胺,易被氧化)