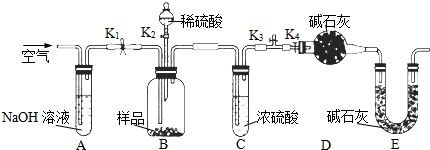
题目内容
配制500mL物质的量浓度为1.00mol/L的NaOH溶液,需要哪些仪器?计算需NaOH的质量为多少?
考点:溶液的配制
专题:计算题
分析:一定容积的容量瓶只能配制相应体积的溶液,配制1.00mol/L的NaOH溶液500mL,所以容量瓶的规格为500mL;根据配制一定物质的量浓度的溶液步骤选用仪器,然后根据n=cV、m=nM计算出氢氧化钠的质量.
解答:
解:根据溶液配制原理,所以固体配制溶液的一般步骤为计算,称量,溶解,移液,洗涤移液,定容,摇匀,500mL物质的量浓度为1.00mol/L的NaOH溶液,所以需要500mL容量瓶,溶解需要用烧杯、玻璃棒,玻璃棒搅拌,加速溶解,移液需要玻璃棒引流,最后需用胶头滴管定容;
配制500mL 1.00mol/L的NaOH溶液,选用氢氧化钠的物质的量为:(NaOH)=1.00mol/L×0.5mL=0.5mol,
选用氢氧化钠的质量为:m(NaOH)=40g/mol×0.5mol=20.0g,
答:需要的仪器为:烧杯、玻璃棒、玻璃棒、胶头滴管;需NaOH的质量为20.0g.
配制500mL 1.00mol/L的NaOH溶液,选用氢氧化钠的物质的量为:(NaOH)=1.00mol/L×0.5mL=0.5mol,
选用氢氧化钠的质量为:m(NaOH)=40g/mol×0.5mol=20.0g,
答:需要的仪器为:烧杯、玻璃棒、玻璃棒、胶头滴管;需NaOH的质量为20.0g.
点评:本题考查溶液的配制,题目难度不大,注意掌握配制一定物质的量浓度的溶液步骤,能够根据配制步骤选用仪器,试题侧重基础知识的考查,配制的学生灵活应用所学知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列叙述正确的是( )
①电子构型为[Ar]3d54s2的元素是过渡元素,②第一电离能:Na<Mg<Al,③任一能层的能级总是从s能级开始,而且能级数等于该能层序数,④基态铬原子的电子排布式 1S22S22p63S23d54S1,⑤某元素质量数51,中子数28,其基态原子未成对电子数为2.
①电子构型为[Ar]3d54s2的元素是过渡元素,②第一电离能:Na<Mg<Al,③任一能层的能级总是从s能级开始,而且能级数等于该能层序数,④基态铬原子的电子排布式 1S22S22p63S23d54S1,⑤某元素质量数51,中子数28,其基态原子未成对电子数为2.
| A、①② | B、③④⑤ |
| C、③⑤ | D、①③④ |
某反应的△H=+100kJ?mol-1,下列有关该反应的叙述正确的是( )
| A、正反应活化能小于100kJ?mol-1 |
| B、逆反应活化能一定小于100kJ?mol-1 |
| C、逆反应反应活化能大于100kJ?mol-1 |
| D、正反应活化能比逆反应活化能大100kJ?mol-1 |

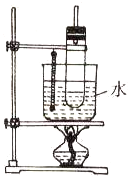 实验室制取硝基苯常用如图装置:
实验室制取硝基苯常用如图装置: