题目内容
下列叙述正确的是( )
①电子构型为[Ar]3d54s2的元素是过渡元素,②第一电离能:Na<Mg<Al,③任一能层的能级总是从s能级开始,而且能级数等于该能层序数,④基态铬原子的电子排布式 1S22S22p63S23d54S1,⑤某元素质量数51,中子数28,其基态原子未成对电子数为2.
①电子构型为[Ar]3d54s2的元素是过渡元素,②第一电离能:Na<Mg<Al,③任一能层的能级总是从s能级开始,而且能级数等于该能层序数,④基态铬原子的电子排布式 1S22S22p63S23d54S1,⑤某元素质量数51,中子数28,其基态原子未成对电子数为2.
| A、①② | B、③④⑤ |
| C、③⑤ | D、①③④ |
考点:原子核外电子排布,原子核外电子的能级分布
专题:
分析:①过渡元素包括副族和ⅥⅡ族,电子构型为[Ar]3d54s2的元素是Mn元素;
②同周期从左到右第一电离能增大,第IIA与IIIA反常;
③在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,能级数等于该能层序数;
④Cr为24号元素,根据核外电子排布规律判断;
⑤质量数51,中子数28,则该元素原子的质子数为51-28=23,根据核外电子排布规律书写基态原子的电子排布式,然后判断未成对电子数.
②同周期从左到右第一电离能增大,第IIA与IIIA反常;
③在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,能级数等于该能层序数;
④Cr为24号元素,根据核外电子排布规律判断;
⑤质量数51,中子数28,则该元素原子的质子数为51-28=23,根据核外电子排布规律书写基态原子的电子排布式,然后判断未成对电子数.
解答:
解:①电子构型为[Ar]3d54s2的元素为Mn元素,处于第四周期ⅦB,是过渡元素,故①正确;
②同周期从左到右第一电离能增大,第IIA与IIIA反常,因为Mg的价电子排布式是3s2,而Al是3s23p1,所以第一电离能:Mg>Al>Na,故②错误;
③能层含有的能级数等于能层序数,即第n能层含有n个能级,每一能层总是从s能级开始,同一能层中能级ns、np、nd、nf的能量依次增大,在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态,所以任一能层的能级总是从s能级开始,而且能级数等于该能层序数,故③正确;
④Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,故④正确;
⑤质量数51,中子数28,则该元素原子的质子数为51-28=23,故该元素基态原子的电子排布式为:1s22s22p63s23p63d34s2,3d能级具有5个轨道,3个电子优先分别占据1个轨道,且自旋方法相同,故有3个成对电子,故⑤错误;
根据以上分析可知,正确的为①③④,
故选D.
②同周期从左到右第一电离能增大,第IIA与IIIA反常,因为Mg的价电子排布式是3s2,而Al是3s23p1,所以第一电离能:Mg>Al>Na,故②错误;
③能层含有的能级数等于能层序数,即第n能层含有n个能级,每一能层总是从s能级开始,同一能层中能级ns、np、nd、nf的能量依次增大,在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态,所以任一能层的能级总是从s能级开始,而且能级数等于该能层序数,故③正确;
④Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,故④正确;
⑤质量数51,中子数28,则该元素原子的质子数为51-28=23,故该元素基态原子的电子排布式为:1s22s22p63s23p63d34s2,3d能级具有5个轨道,3个电子优先分别占据1个轨道,且自旋方法相同,故有3个成对电子,故⑤错误;
根据以上分析可知,正确的为①③④,
故选D.
点评:本题考查了原子核外电子排布、原子核外电子能级分布等知识,题目难度中等,注意掌握常见元素的原子结构、原子核外电子排布特点,明确原子核外电子能级分布情况,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
一种高聚物分子B结构如图所示

B是制造优良高频电绝缘材料的树脂,它是由a、b、c 3种单体通过缩聚反应脱掉小分子H2O而生成的,则a、b、c 3种单体的结构简式依次是( )

B是制造优良高频电绝缘材料的树脂,它是由a、b、c 3种单体通过缩聚反应脱掉小分子H2O而生成的,则a、b、c 3种单体的结构简式依次是( )
A、 、HCHO和 、HCHO和 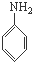 |
B、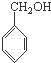 、CH3OH和 、CH3OH和 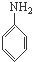 |
C、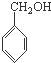 、HCHO和 、HCHO和 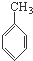 |
D、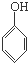 、CH3CHO和 、CH3CHO和 |
下列物质中,含有极性键和非极性键的是( )
| A、CO2 |
| B、H2O |
| C、Br2 |
| D、H2O2 |
 硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):
硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):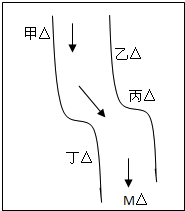 在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断:
在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断: