题目内容
实验室需要配制480mL 0.4mol/L的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解,②把①所得溶液小心转入一定容积的容量瓶中,③继续向容量瓶中加蒸馏水至液面距刻度线1-2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切,④用少量蒸馏水洗涤烧杯和玻璃棒2-3 次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀,⑤将 容量瓶瓶塞塞紧,充分摇匀.请填写下列空白:
(1)操作步骤的正确顺序为 (填序号).
(2)本实验应选用 mL的容量瓶,应称取NaCl晶体的质量为 .
(3)误差分析(填“偏高”、“偏低”、“无影响”):
①称量NaCl晶体时,物码放反(1g以下用游码) ,②定容时俯刻度线 ,
③没有进行操作步骤④ ,④加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出 ,⑤容量瓶中原来有少量蒸馏水 .
(1)操作步骤的正确顺序为
(2)本实验应选用
(3)误差分析(填“偏高”、“偏低”、“无影响”):
①称量NaCl晶体时,物码放反(1g以下用游码)
③没有进行操作步骤④
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)配制时,一般可分为以下几个步骤:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀,据此进行排序;
(2)选用容量瓶的规格要等于或稍大于配制溶液的体积;根据m=cVM计算出需要氯化钠的质量;
(3)根据c=
分析操作对溶质的物质的量或对溶液的体积的影响判断,如果n偏大或V偏小,则所配制溶液浓度偏高,如果n偏小或V偏大,则所配制溶液的浓度偏低.
(2)选用容量瓶的规格要等于或稍大于配制溶液的体积;根据m=cVM计算出需要氯化钠的质量;
(3)根据c=
| n |
| V |
解答:
解:(1)配制时,一般可分为以下几个步骤:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀,所以其操作步骤的正确顺序为:①②④③⑤,
故答案为:①②④③⑤;
(2)实验室没有480mL的容量瓶,需要选取规格为500mL的容量瓶;
配制500mL 0.4mol/L的氯化钠溶液,需要氯化钠的质量为:58.5g/mol×0.4mol/L×0.5L=11.7g,
故答案为:500;11.7g;
(3)①称量NaCl时,物码倒置(1g以下用游码),导致溶质的物质的量偏小,所以配制溶液的浓度偏低,
故答案为:偏低;
②定容时俯视液面,导致溶液的体积偏小,则配制溶液的浓度偏高,
故答案为:偏高;
③没有洗涤玻璃棒和烧杯导致溶质的物质的量偏小,所以配制溶液的浓度偏低,
故答案为:偏低;
④用胶头滴管吸出的溶液中含有溶质,导致溶质的物质的量偏小,所以配制溶液的浓度偏低,
故答案为:偏低;
⑤容量瓶原来有少量水,不影响溶质的物质的量和溶液的体积,所以对配制溶液的浓度无影响,
故答案为:无影响.
故答案为:①②④③⑤;
(2)实验室没有480mL的容量瓶,需要选取规格为500mL的容量瓶;
配制500mL 0.4mol/L的氯化钠溶液,需要氯化钠的质量为:58.5g/mol×0.4mol/L×0.5L=11.7g,
故答案为:500;11.7g;
(3)①称量NaCl时,物码倒置(1g以下用游码),导致溶质的物质的量偏小,所以配制溶液的浓度偏低,
故答案为:偏低;
②定容时俯视液面,导致溶液的体积偏小,则配制溶液的浓度偏高,
故答案为:偏高;
③没有洗涤玻璃棒和烧杯导致溶质的物质的量偏小,所以配制溶液的浓度偏低,
故答案为:偏低;
④用胶头滴管吸出的溶液中含有溶质,导致溶质的物质的量偏小,所以配制溶液的浓度偏低,
故答案为:偏低;
⑤容量瓶原来有少量水,不影响溶质的物质的量和溶液的体积,所以对配制溶液的浓度无影响,
故答案为:无影响.
点评:本题考查了一定物质的量浓度溶液的配制、仪器的选择以及误差分析,题目难度不大,注意选用容量瓶的规格要等于或稍大于配制溶液的体积,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关说法正确的是( )
| A、铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连 | ||
| B、用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | ||
| C、一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0 | ||
D、SO2(g)+2CO(g)
|
一种高聚物分子B结构如图所示

B是制造优良高频电绝缘材料的树脂,它是由a、b、c 3种单体通过缩聚反应脱掉小分子H2O而生成的,则a、b、c 3种单体的结构简式依次是( )

B是制造优良高频电绝缘材料的树脂,它是由a、b、c 3种单体通过缩聚反应脱掉小分子H2O而生成的,则a、b、c 3种单体的结构简式依次是( )
A、 、HCHO和 、HCHO和 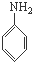 |
B、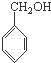 、CH3OH和 、CH3OH和 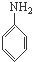 |
C、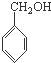 、HCHO和 、HCHO和 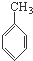 |
D、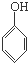 、CH3CHO和 、CH3CHO和 |
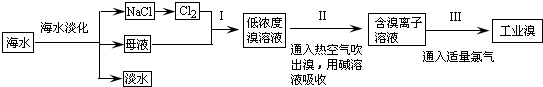
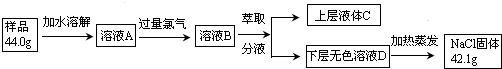
 硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):
硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):