题目内容
2.还原剂还原法、光催化氧化法、电化学吸收法是减少氮氧化物排放的有效措施.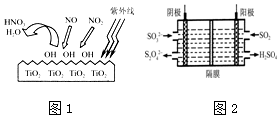
①TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如图1所示,OH与NO2的反应为NO2+OH═HNO3.写出OH与NO反应的化学方程式:3OH+NO═HNO3+H2O.
②如图2所示的装置能吸收和转化NO2、NO和SO2,阴极排出的溶液中含S2O42-离子,能吸收NOx气体,生成的SO32-可在阴极区再生.将S2O42-吸收NO2的离子方程式配平,并在方格内填上相应物质:
4S2O42-+2NO2+8OH-═SO32-+1N2+4H2O□.
分析 (1)依据图象可知NO、NO2均被OH氧化为HNO3,依据原子守恒得到;
(2)其中S2O42-中硫元素为+3价,而硫酸根中硫元素为+4价,化合价升高2价;二氧化氮中的氮元素化合价为+4价,氮气为0价,化合价降低8价,根据化合价升降守恒得,最小公倍数为8,故S2O42-前系数为4,N2前系数为1,并根据原子守恒进行配平.
解答 解:(1)由图象可知NO、NO2均被OH氧化为HNO3,依据原子守恒得到,NO+3OH═HNO3+H2O,
故答案为:3OH+NO═HNO3+H2O;
(2)其中S2O42-中硫元素为+3价,而硫酸根中硫元素为+4价,化合价升高2价;二氧化氮中的氮元素化合价为+4价,氮气为0价,化合价降低8价,根据化合价升降守恒得,最小公倍数为8,故S2O42-前系数为4,N2前系数为1,并根据原子守恒进行配平,故离子方程式为4S2O42-+2NO2+8OH-═
8SO42-+N2+4H2O,
故答案为:4;2;8;8;1;4H2O.
点评 本题考查了方程式的书写,氧化还原反应中利用化合价升降守恒,原子守恒的配平,并且学会分析利用题干信息的能力,题目难度中等.

练习册系列答案
相关题目
10.下列叙述正确的是( )
| A. | 化合反应大多数是放热反应,分解反应全都是吸热反应 | |
| B. | C(金刚石,s)+O2(g)=CO2(g)的反应热等于1molO2的键能与1molCO2中键能的差 | |
| C. | 热化学方程式中,反应条件可以不写,而且各物质前的化学计量数可以是分数 | |
| D. | 如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应 |
17.下列离子方程式正确的是( )
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 饱和石灰水跟盐酸反应:H++OH-═H2O | |
| C. | 在硫酸溶液中加入氢氧化钡溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 碳酸钙中加入盐酸:CO32-+2H+═CO2↑+H2O |
7.下列说法正确的是( )
| A. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| B. | 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 | |
| C. | 制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 | |
| D. | 在3S+6KOH=2K2S+K2SO3+3H2O反应中,作氧化剂的S原子与作还原剂的S原子的物质的量之比是1:2 |
 天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.