题目内容
10.下列叙述正确的是( )| A. | 化合反应大多数是放热反应,分解反应全都是吸热反应 | |
| B. | C(金刚石,s)+O2(g)=CO2(g)的反应热等于1molO2的键能与1molCO2中键能的差 | |
| C. | 热化学方程式中,反应条件可以不写,而且各物质前的化学计量数可以是分数 | |
| D. | 如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应 |
分析 A.CaO与水化合为放热反应,C与二氧化碳化合反应为吸热反应;绝大多数的分解反应为吸热反应,过氧化氢分解为放热反应;
B.焓变等于反应物中键能之和减去生成物中键能之和;
C.热化学方程式中化学计量数表示物质的量;
D.反应物所具有的总能量小于生成物所具有的总能量,需要吸收能量.
解答 解:A.吸热反应、放热反应与基本反应类型无关,故A错误;
B.C(金刚石,s)+O2(g)=CO2(g)的反应热等于1molO2的键能与1mol金刚石中的键能之和减去1molCO2中键能,故B错误;
C.热化学方程式中化学计量数表示物质的量,则反应条件可以不写,而且各物质前的化学计量数可以是分数,故C正确;
D.反应物所具有的总能量小于生成物所具有的总能量,需要吸收能量,为吸热反应,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、焓变的计算为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
1.在体积为2L的密闭容器中,充入6mol N2,10mol H2,发生反应:N2(g)+3H2(g)?2NH3(g)反应进行5min时,测得NH3的浓度为1mol•L-1,在此时间内,下列反应速率表示正确的是( )
| A. | v(NH3)=0.1mol•L-1•min-1 | B. | v(N2)=0.7 mol•L-1•min-1 | ||
| C. | v(NH3)=0.2mol•L-1•min-1 | D. | v(H2)=0.3mol•L-1•min-1 |
18.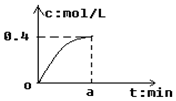 反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
 反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 5 | B. | 2.5 | C. | 7.5 | D. | 10 |
5.下列说法中正确的是( )
| A. | 标准状况下,22.4 L水中所含的分子数约为6.02×1023个 | |
| B. | 1 mol Cl2中含有的原子数为NA | |
| C. | 标准状况下,a L氧气和氮气的混合物含有的分子数约为$\frac{a}{22.4}$×6.02×1023个 | |
| D. | 常温常压下,11.2 L CO分子数是0.5NA |
15.下列说法正确的是( )
①非金属元素构成的单质中一定存在共价键;②非金属之间形成的化合物一定是共价化合物;③非金属的气态氢化物中一定存在极性共价键;④离子化合物中一定含有离子键;⑤金属元素和非金属元素形成的化合物一定是离子化合物;⑥在一种化合物中只能存在一种类型的化学键;⑦含共价键的化合物不一定是共价化合物;⑧含离子键的化合物一定是离子化合物;⑨氯化钠和HCl溶于水都发生电离,克服粒子间作用力的类型相同.
①非金属元素构成的单质中一定存在共价键;②非金属之间形成的化合物一定是共价化合物;③非金属的气态氢化物中一定存在极性共价键;④离子化合物中一定含有离子键;⑤金属元素和非金属元素形成的化合物一定是离子化合物;⑥在一种化合物中只能存在一种类型的化学键;⑦含共价键的化合物不一定是共价化合物;⑧含离子键的化合物一定是离子化合物;⑨氯化钠和HCl溶于水都发生电离,克服粒子间作用力的类型相同.
| A. | ③④⑦⑧ | B. | ①③④⑦⑧ | C. | ②⑤⑥⑧⑨ | D. | ①④⑦⑨ |
19.某干电池在使用过程中发生的主要反应可用下列化学方程式表示:Zn+2MnO2+2NH4Cl(aq)═2MnO(OH)(s)+[Zn(NH3)2]Cl2(aq),其正极反应式是( )
| A. | 2MnO2+2NH4++2e-═2MnO(OH)+2NH3 | B. | Zn-2e-═Zn2+ | ||
| C. | [Zn(NH3)2]2++2e-═Zn+2NH3 | D. | Mn4++e-═Mn3+ |
 H2(g)+I2(g); △H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是( )
H2(g)+I2(g); △H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是( )