题目内容
16.在一定条件下,恒容的密闭容器中发生如下反应:2SO2 (g)+O2(g)?2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2mol•L-1、0.1mol•L-1、0.2mol•L-1,当反应达到平衡时,可能出现的数据是( )| A. | C(SO3)=0.4mol•L-1 | B. | C(SO3)+C(SO2)=0.3 mol•L-1 | ||
| C. | C(O2)=0.3mol•L-1 | D. | C(SO3)=0.35 mol•L-1 |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,由于硫元素守恒,c(SO3)+c(SO2)之和不变,据此判断分析.
解答 解:A、SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,由方程式2SO2 (g)+O2(g)?2SO3(g)可知SO3的浓度的浓度变化为0.2mol/L,实际变化小于该值,故c(SO3)小于0.4 mol/L,故A错误;
B、由于硫元素守恒,c(SO3)+c(SO2)=0.2mol•L-1+0.2mol•L-1=0.4mol•L-1,故B错误;
C、O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,由方程式2SO2 (g)+O2(g)?2SO3(g)可知O2的浓度浓度变化为0.1mol/L,实际变化应小于该值,故c(O2)小于0.2 mol/L,故C错误;
D、由于硫元素守恒,c(SO3)+c(SO2)=0.2mol•L-1+0.2mol•L-1=0.4mol•L-1,c(SO3)小于0.4 mol/L,故D正确;
故选D.
点评 本题考查可逆反应特点,利用极限转化的思想来分析物质的最大浓度,但实际浓度一定小于最大浓度,难度不大.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
6.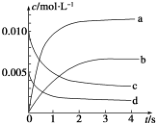 在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)用O2的反应速率表示 0~2s 内该反应的平均反应速率 v=1.5×10-3mol•L-1•s-1.若上述反应在850℃下进行,反应2s时 n(NO)=0.009mol,并且不再随时间而改变,则该反应是放热反应.
(2)图中表示NO2浓度变化的曲线是b(填字母).
(3)能说明该反应已达到平衡状态的是BC(填序号).
A.v(NO2)=2v(O2)
B.容器内的压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内气体密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C(填序号).
A.及时分离出NO2
B.适当升高温度
C.增大O2的浓度
D.选择高效催化剂.
 在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2浓度变化的曲线是b(填字母).
(3)能说明该反应已达到平衡状态的是BC(填序号).
A.v(NO2)=2v(O2)
B.容器内的压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内气体密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C(填序号).
A.及时分离出NO2
B.适当升高温度
C.增大O2的浓度
D.选择高效催化剂.
7.下列状态的物质,既能导电又属于电解质的是( )
| A. | 液态氯化氢 | B. | NaCl晶体 | C. | 熔融的KNO3 | D. | CuSO4溶液 |
4.下面是几种常见的化学电源,其中属于一次电池的是( )
| A. | 干电池 | B. | 铅蓄电池 | C. | 燃料电池 | D. | 锂离子电池 |
11.镍镉电池在通讯、交通及日常生活中有着广泛的应用,其工作原理可以表示为:Cd+2NiO(OH)+2H2O?2Ni(OH)2+Cd(OH)2以下说法中正确的是( )
| A. | 以上反应是可逆反应 | |
| B. | 放电时,镉为正极 | |
| C. | 充电时电池上标有“+”号的电极连接电源正极 | |
| D. | 以镍镉电池为电源,电解Na2CO3溶液,当收集到气体的总体积为33.6L电池中转移了2mol电子 |
1.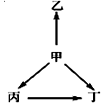 下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )
下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )
 下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )
下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )| 选项 | 甲 | 乙 | 丙 | 丁 | |
| A | S | SO2 | SO3 | H2SO4 | |
| B | N2 | NH3 | NO | NO2 | |
| C | CuO | Cu | Cu(OH)2 | CuCl2 | |
| D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
| A. | A | B. | B | C. | C | D. | D |
5.下列热化学方程式正确的是(注:△H的数值均正确)( )
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l);△H=-57.3kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g);△H=-269.8kJ/mol(反应热) | |
| D. | 2NO2═O2+2NO;△H=+116.2kJ/mol(反应热) |
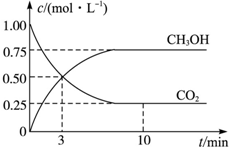 工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.
工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.