题目内容
7.下列说法中用离子方程式表达正确的是( )| A. | 氯气溶于水:Cl2+H2O?H++Cl-+HClO | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2A1 (OH)3↓+CO32- | |
| C. | Fe(NO3)2溶液中滴加少量稀盐酸:Fe2++NO3-+4H+=Fe3++NO↑+2H2O | |
| D. | 用醋酸溶液除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
分析 A.二者反应生成氯化氢和次氯酸,次氯酸为弱酸保留化学式;
B.二氧化碳过量反应生成氢氧化铝沉淀和碳酸氢钠;
C.得失电子不守恒,电荷不守恒;
D.醋酸为弱酸保留化学式.
解答 解:A.氯气溶于水,离子方程式:Cl2+H2O?H++Cl-+HClO,故A正确;
B.向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=A1 (OH)3↓+HCO3-,故B错误;
C.Fe(NO3)2溶液中滴加少量稀盐酸,离子方程式:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故C错误;
D.用醋酸溶液除去水垢,离子方程式:2CH3COOH+CaCO3=Ca2++CO2↑+H2O+2CH3COO-,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意弱电解质应保留化学式,注意离子反应遵循原子个数、电荷数、得失电子数守恒规律,题目难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
18.已知强酸与强碱完全反应的中和热为57.3kJ/moL,且生成沉淀要放出热量,下列反应的△H值大于57.3kJ/moL的是( )
| A. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l) | |
| B. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l) | |
| C. | CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l) | |
| D. | NH3•H2O(aq)+HCl(aq)═NH4Cl(aq)+H2O(l) |
15.甲、乙两种粒子都只含有一个原子核,且核内具有相同数目的质子,这两种微粒一定是( )
| A. | 同种原子 | B. | 同种元素 | ||
| C. | 互为同位素 | D. | 具有相同的核外电子排布 |
2.下列关于煤及其综合利用的说法中正确的是( )
| A. | 煤的主要成分是单质碳 | |
| B. | 煤的干馏是指将煤在空气中加强热使之分解的过程 | |
| C. | 煤通过干馏得到的苯和甲苯属于同系物 | |
| D. | 煤气化的目的主要是获得甲烷,煤液化的目的主要是获得苯 |
16.某气体能使湿润的红色石蕊试纸变蓝,则该气体是( )
| A. | NO | B. | NH3 | C. | Cl2 |
17. 用图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )
用图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )
 用图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )
用图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )| 选项 | 气体 | a | b | c | d |
| A | SO2 | 浓硫酸 | Cu | H2O | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| C | NH3 | 饱和NH4Cl溶液 | 消石灰 | 空集气瓶 | 固体NaOH |
| D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O. (1)写出下列反应的化学方程式:
(1)写出下列反应的化学方程式: .
.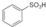 ),根据质量守恒定律,可判断出另一个反应产物为H2O.
),根据质量守恒定律,可判断出另一个反应产物为H2O.