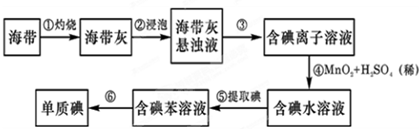
题目内容
11.钙元素是人体必需的常量元素,所有细胞都需要钙元素.正常人体血液含Ca2+为2.2×10-3~2.7×10-3 mol/L.先抽取某人血样10mL,稀释后用草酸铵 (NH4)2C2O4]溶液处理,使Ca2+完全变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0mL 5.0×10-3 mol/L KMnO4溶液与溶解得到的草酸恰好完全反应.求此人血液中Ca2+的浓度,并判断其血液含钙量是否正常.(提示:2KMnO4+5H2C2O4+3H2SO4=2MnO4+K2SO4+10CO2+8H2O)分析 根据方程式计算草酸钙的物质的量,根据元素守恒可知血液中钙离子物质的量再计算浓度.
解答 解:消耗高锰酸钾的物质的量为:5.0×10-3mol/L×0.002L=1×10-5mol,
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O
2 5
1×10-5mol n(H2C2O4)
$\frac{2}{1×1{0}^{-5}mol}$=$\frac{5}{n({H}_{2}{C}_{2}{O}_{4})}$,
n(H2C2O4)=2.5×10-5mol,
C2O42------H2C2O4----CaC2O4---Ca2+
1 1 1 1
2.5×10-5mol n(Ca2+)
n(Ca2+)=2.5×10-5mol
CCa2+)=$\frac{n(C{a}^{2+})}{V}$=$\frac{2.5×1{0}^{-5}mol}{0.01L}$=2.5×10-3mol/L,
浓度为$\frac{2×1{0}^{-5}}{0.01L}$mol=2.5×10-3 mol/L,介于2.2×10-3~2.7×10-3 mol/L之间,所以此人健康,
答:此人血液中的Ca2+的物质的量浓度为2.5×10-3 mol/L,此人健康.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化、反应中物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
1.“烯烃复分解反应”是指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程.如:两分子烯烃RCH=CHR′用上述催化剂作用会生成两种新的烯烃R′CH=CHR′和RCH=CHR.则由CH2=CHCH2CH3和CH2=C(CH3)2发生“烯烃复分解反应”,生成新烯烃种类为( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
2.大脑的生长发育与不饱和脂肪酸密切相关,深海鱼油中提取的“DHA”就是一种不饱和程度很高的脂肪酸,称为“脑黄金”,它的分子中含有6个碳碳双键,名称为二十六碳六烯酸,其化学式为( )
| A. | C25H41COOH | B. | C26H41COOH | C. | C25H39COOH | D. | C26H43COOH |
16.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下11.2 L甲烷含有2NA个共价键 | |
| B. | 4.8 g Mg和氯气反应得到电子数为0.4 NA个 | |
| C. | 0.1 mol•L-1的氢氧化钠溶液中含钠离子数为0.1NA个 | |
| D. | 5.6 g铁与足量的稀硫酸反应失去电子数为0.3NA个 |
3.下列说法正确的是( )
| A. | 16O2、18O2互为同位素 | B. | H2O、D2O、T2O的化学性质不同 | ||
| C. | 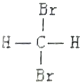 和 和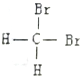 是两种不同结构 是两种不同结构 | D. | 白磷与红磷互为同素异形体 |
6.只用一种试剂,可区别Na2SO4、NH4Cl、MgSO4四种溶液,这种试剂是( )
| A. | HCl | B. | BaCl2 | C. | AgNO3 | D. | NaOH |
7.下列说法中用离子方程式表达正确的是( )
| A. | 氯气溶于水:Cl2+H2O?H++Cl-+HClO | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2A1 (OH)3↓+CO32- | |
| C. | Fe(NO3)2溶液中滴加少量稀盐酸:Fe2++NO3-+4H+=Fe3++NO↑+2H2O | |
| D. | 用醋酸溶液除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |