题目内容
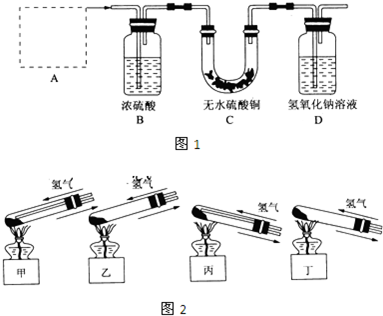
 实验室制氯气的实验装置图如下所示:
实验室制氯气的实验装置图如下所示:(1)连接好装置后,实验前必须进行的操作是
(2)甲中盛有
(3)乙中盛有
(4)集气瓶丙中导气管需要伸入集气瓶底部的原因是
(5)丁中盛有
考点:氯气的实验室制法
专题:
分析:(1)连接好装置后必须进行检查装置气密性,确保装置气密性良好,避免氯气泄漏污染空气;
(2)氯化氢具有挥发性,所以制取的氯气中含有杂质氯化氢,甲装置装有饱和食盐水,用于除去氯气的中的氯化氢;
(3)实验室中,利用浓盐酸和二氧化锰在加热条件下制取氯气,所以制取的氯气中含有杂质水蒸气,通过浓硫酸除去水蒸气;
(4)氯气的密度大于空气,通常采用向上排空气法收集氯气,导管插入管底有利于排净空气;
(5)氯气是一种有毒气体,多余的氯气不能直接排放,应该使用尾气吸收装置,根据氯气的化学性质选用吸收试剂,并写出反应的方程式.
(2)氯化氢具有挥发性,所以制取的氯气中含有杂质氯化氢,甲装置装有饱和食盐水,用于除去氯气的中的氯化氢;
(3)实验室中,利用浓盐酸和二氧化锰在加热条件下制取氯气,所以制取的氯气中含有杂质水蒸气,通过浓硫酸除去水蒸气;
(4)氯气的密度大于空气,通常采用向上排空气法收集氯气,导管插入管底有利于排净空气;
(5)氯气是一种有毒气体,多余的氯气不能直接排放,应该使用尾气吸收装置,根据氯气的化学性质选用吸收试剂,并写出反应的方程式.
解答:
解:(1)该实验装置中连接了多个仪器,且氯气是一种有毒气体,不避免氯气泄漏,会污染空气且浪费试剂,所以在实验前需要检验装置气密性,
故答案为:检查装置气密性;
(2)根据装置可知甲、乙为净化和干燥氯气的装置,氯气因为混有挥发出的HCl气体,可用饱和食盐水除去HCl气体,
故答案为:饱和食盐水;除去氯气中的氯化氢;
(3)实验室中,利用浓盐酸和二氧化锰在加热条件下制取氯气,所以制取的氯气中含有杂质水蒸气,氯气为酸性气体,可通过浓硫酸吸收水蒸气得到干燥纯净的氯气;
故答案为:浓硫酸;干燥氯气;
(4)氯气密度大于空气,所以采用向上排空气法收集,导管插入管底有利于排净空气,
故答案为:氯气的密度比空气的密度大,导管插入管底有利于排净空气;
(5)氯气有毒,需要进行尾气吸收,氯气与氢氧化钠溶液反应,所以尾气吸收可以用氢氧化钠溶液,反应的方程式为,2NaOH+Cl2=NaCl+NaClO+H2O,
故答案为:氢氧化钠溶液(碱液);2NaOH+Cl2=NaCl+NaClO+H2O.
故答案为:检查装置气密性;
(2)根据装置可知甲、乙为净化和干燥氯气的装置,氯气因为混有挥发出的HCl气体,可用饱和食盐水除去HCl气体,
故答案为:饱和食盐水;除去氯气中的氯化氢;
(3)实验室中,利用浓盐酸和二氧化锰在加热条件下制取氯气,所以制取的氯气中含有杂质水蒸气,氯气为酸性气体,可通过浓硫酸吸收水蒸气得到干燥纯净的氯气;
故答案为:浓硫酸;干燥氯气;
(4)氯气密度大于空气,所以采用向上排空气法收集,导管插入管底有利于排净空气,
故答案为:氯气的密度比空气的密度大,导管插入管底有利于排净空气;
(5)氯气有毒,需要进行尾气吸收,氯气与氢氧化钠溶液反应,所以尾气吸收可以用氢氧化钠溶液,反应的方程式为,2NaOH+Cl2=NaCl+NaClO+H2O,
故答案为:氢氧化钠溶液(碱液);2NaOH+Cl2=NaCl+NaClO+H2O.
点评:本题考查了氯气的实验室制法及氯气化学性质,题目难度中等,氯气的氧化性及实验室制法是高考的热点,注意熟练掌握反应原理,明确氯气有毒等性质是解答该题的关键.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数,下列说法中不正确的是( )
| A、0.5mol O3 和11.2L O2的体积一定相等 |
| B、5.6 gFe与足量的稀盐酸充分反应后,转移的电子数为0.2NA |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D、1L 0.1mol/L的醋酸溶液中H+数目为0.1 NA |
把0.05molBa(OH)2固体分别加入到下列100mL液体中,溶液导电性基本不变.该液体是( )
| A、1.0mol/L盐酸 |
| B、自来水 |
| C、0.5mol/L硫酸 |
| D、1.0mol/L氨水 |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断正确的是( )
| 实验编号 | 起始浓度/(mol?L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中:c(A-)>c(K+)>c(OH-)>c(H+) | ||
B、实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=
| ||
| C、实验②反应后的溶液中:c(A-)+c(HA)<0.1 mol/L | ||
| D、实验②反应后的溶液中:c(K+)+c(OH-)=c(H+)+c(A-) |
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)?3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是( )
| A、2molC |
| B、2 molA、1 molB和1 molHe(不参加反应) |
| C、1 molB和1 molC |
| D、2 molA、2 molB和3 molC |
下列物质中,既能发生消去反应生成烯烃,又能发生氧化反应生成醛的是( )
| A、甲醇 |
| B、2-甲基-2-丙醇 |
| C、2-甲基-1-丙醇 |
| D、2-丁醇 |