题目内容
18.W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )

| A. | 最高化合价X>Y>Z>W | |
| B. | 气态氢化物的稳定性Z>Y>W | |
| C. | Y的氧化物与X、Z的最高价氧化物对应的水化物均能反应 | |
| D. | 由X、Z、W三种元素形成的化合物一定既含离子键又含共价键 |
分析 W、X、Y、Z是四种常见的短周期元素,已知W的一种核素的质量数为18,中子数为10,则W元素原子的质子数为18-10=8,故W为氧元素;X和Ne原子的核外电子数相差1,X为Na或F,X原子半径大于氧原子,故X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na元素,故Y为Si元素;Z的非金属性在同周期元素中最强,故Z为Cl元素,据此解答.
解答 解:W、X、Y、Z是四种常见的短周期元素,已知W的一种核素的质量数为18,中子数为10,则W元素原子的质子数为18-10=8,故W为氧元素;X和Ne原子的核外电子数相差1,X为Na或F,X原子半径大于氧原子,故X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na元素,故Y为Si元素;Z的非金属性在同周期元素中最强,故Z为Cl元素,
A.Z(Cl)、Y(Si)、X(Na)元素的最高价依次为+7、+4、+1,故A错误;
B.非金属性W(O)>Y(Si),故氢化物稳定性Y<W,故B错误;
C.二氧化硅能与氢氧化钠反应生成硅酸钠与水,除氢氟酸外二氧化硅不溶于其它酸,不能与高氯酸反应,故C错误;
D.化合物NaClO中钠离子与次氯酸根离子之间形成离子键,次氯酸根中氯原子与氧原子之间形成共价键,故D正确,
故选D.
点评 本题考查位置结构性质关系应用,难度中等,推断元素是解题的关键,注意对元素周期律的理解与运用.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
13.下列除杂质(括号中物质为杂质)所用试剂或方法不正确的是( )
| A. | Cu2+(Fe3+):足量的Fe粉 | B. | MgO(Al2O3):足量的Ba(OH)2溶液 | ||
| C. | NaHCO3溶液(Na2CO3):足量的CO2 | D. | CO2(HCl):饱和NaHCO3溶液 |
9.下列说法不正确的是( )
| A. | 在氧化还原反应中,氧化剂与还原剂不一定是两种不同的反应物 | |
| B. | 在氧化还原反应中,生成物不一定是氧化产物或还原产物 | |
| C. | 元素由化合态转化为游离态时,该元素一定被还原 | |
| D. | 有单质参加的反应不一定属于氧化还原反应 |
13.已知氧化性Br2>Fe3+.FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-
下列选项中的数字与离子方程式中的a.b.c.d.e.f一一对应,其中不符合反应实际的是( )
a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-
下列选项中的数字与离子方程式中的a.b.c.d.e.f一一对应,其中不符合反应实际的是( )
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
3.常温下,有下列四种溶液:
下列说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5 | |
| C. | ①与③等体积混合后溶液PH为a,②与④等体积混合后溶液PH为b.则a>b | |
| D. | 1ml③和100ml④分别与足量金属镁反应,产生的H2一样多 |
8.在0.1mol/L的CH3COOH溶液中存在如下电离平衡CH3COOH?CH3COO-+H+对于该平衡,下列叙述正确的是( )
| A. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| B. | 加水,反应速率增大,平衡向逆反应方向移动 | |
| C. | 滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
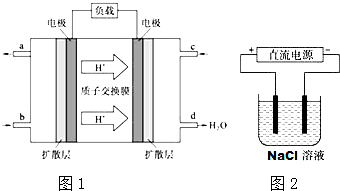
 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.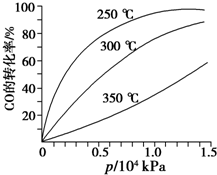 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.