题目内容
13.下列除杂质(括号中物质为杂质)所用试剂或方法不正确的是( )| A. | Cu2+(Fe3+):足量的Fe粉 | B. | MgO(Al2O3):足量的Ba(OH)2溶液 | ||
| C. | NaHCO3溶液(Na2CO3):足量的CO2 | D. | CO2(HCl):饱和NaHCO3溶液 |
分析 A.发生反应Fe+Cu2+=Fe2++Cu;
B.Al2O3是两性氧化物,具有两性氧化物的通性,溶于强酸强碱;
C.Na2CO3和水、CO2反应生成NaHCO3;
D.氯化氢能与碳酸氢钠反应.
解答 解:A.发生反应Fe+Cu2+=Fe2++Cu,引入新的杂质,故A错误;
B.MgO不与氢氧化钠溶液反应,而Al2O3能和氢氧化钠溶液反应化学方程式:Al2O3+2NaOH═2NaAlO2+H2O,可除去杂质,故B正确;
C.Na2CO3和水、CO2反应生成NaHCO3,反应方程式为Na2CO3+H2O+CO2=2NaHCO3,故C正确;
D.氯化氢都能与碳酸氢钠反应生成二氧化碳,可除杂,故D正确.
故选A.
点评 本题考查物质的分离、提纯,侧重于学生的分析能力、实验能力和评价能力的考查,难度不大,注意把握物质的性质的异同,注意除杂时不能引入新的杂质.

练习册系列答案
相关题目
3.下列各组物质中属于纯净物的是( )
| A. | 氨水 | B. | 氢氧化铁胶体 | C. | 混有冰的水 | D. | 石灰石 |
4.与50mL 0.1mol/L Na2CO3溶液中Na+的物质的量浓度相同的溶液是( )
| A. | 25 mL 0.2mol/L的NaCl溶液 | B. | 100mL 0.1 mol/L的NaCl溶液 | ||
| C. | 25 mL 0.2 mol/L的Na2SO4溶液 | D. | 10 mL 0.5 mol/L的Na2CO3溶液 |
5.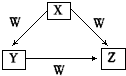 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y、Z、W可能是( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y、Z、W可能是( )
①C、CO ②AlCl2、Al(OH)3 ③Na2CO3、NaHCO3.
 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y、Z、W可能是( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y、Z、W可能是( )①C、CO ②AlCl2、Al(OH)3 ③Na2CO3、NaHCO3.
| A. | ①②③ | B. | ①② | C. | ② | D. | ① |
17.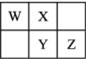 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )| A. | Y元素氧化物对应水化物的酸性一定弱于Z | |
| B. | W、X、Y中最简单氢化物稳定性最强的是X | |
| C. | X元素形成的单核阴离子还原性大于Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
18.W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是
( )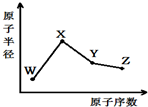
( )

| A. | 最高化合价X>Y>Z>W | |
| B. | 气态氢化物的稳定性Z>Y>W | |
| C. | Y的氧化物与X、Z的最高价氧化物对应的水化物均能反应 | |
| D. | 由X、Z、W三种元素形成的化合物一定既含离子键又含共价键 |
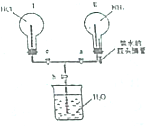 某实验小组在实验室中制取氨气并设计实验验证氨气的某些性质.
某实验小组在实验室中制取氨气并设计实验验证氨气的某些性质.