题目内容
7.8g过氧化钠与足量水反应后,将会产生多少摩尔NaOH,生成的O2在标准状况下所占的体积是多少?
考点:化学方程式的有关计算
专题:计算题
分析:根据n=
计算7.8g过氧化钠的物质的量,再根据方程式中对比关系计算生成氢氧化钠、氢气的物质的量,根据V=nVm计算氢气的体积.
| m |
| M |
解答:
解:7.8g过氧化钠的物质的量=
0.1mol,
2Na2O2+2H2O═4NaOH+O2↑
2 4 l
0.1mol n(NaOH) n(O2)
所以n(NaOH)=
=0.2mol
n(O2)=
=0.05mol
故标况下,生成氧气体积=0.05mol×22.4L/mol=1.12L,
答:生成氢氧化钠为0.2mol,标况下生成氧气为1.12L.
| 7.8g |
| 78g/mol |
2Na2O2+2H2O═4NaOH+O2↑
2 4 l
0.1mol n(NaOH) n(O2)
所以n(NaOH)=
| 0.1mol×4 |
| 2 |
n(O2)=
| 0.1mol×1 |
| 2 |
故标况下,生成氧气体积=0.05mol×22.4L/mol=1.12L,
答:生成氢氧化钠为0.2mol,标况下生成氧气为1.12L.
点评:本题考查化学方程式的计算,比较基础,注意反应方程式的书写,有利于基础知识的巩固.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是( )
| A、HCl NH4Cl CH3COOH NaNO3 Na2CO3 NaHCO3 NaOH |
| B、HCl NH4Cl CH3COOH NaHCO3 NaNO3 Na2CO3 NaOH |
| C、HCl CH3COOH NH4Cl NaNO3 NaHCO3 Na2CO3 NaOH |
| D、HCl CH3COOH NH4Cl NaNO3 Na2CO3 NaHCO3 NaOH |
 某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题: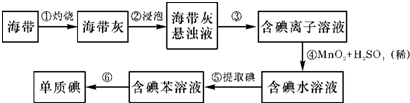

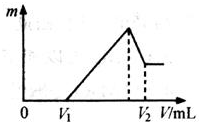 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
 过硫酸:
过硫酸:
 (b)
(b) (c)H2O2(d)
(c)H2O2(d) (e)
(e)
 (g)O3 (h)
(g)O3 (h)