题目内容
Ⅰ.实验室需配制500mL 0.2mol/L NaCl溶液.
(1)本实验用到的仪器已有药匙、烧杯、量筒、托盘天平(砝码、镊子)、玻璃棒、胶头滴管,还缺少的玻璃仪器是 .
(2)配制时,需称取NaCl的质量是 g.
(3)在配制过程中,其它操作都正确的情况下,下列操作会导致所配制的溶液浓度偏高的是 .(选填序号)
①没有洗涤烧杯和玻璃棒 ②定容时俯视标线 ③容量瓶不干燥,含有少量蒸馏水
Ⅱ.为了讲授“氯气的性质和用途”,老师用二氧化锰和浓盐酸制取氯气,并设计了如图所示装置(其中A是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)进行了教学.
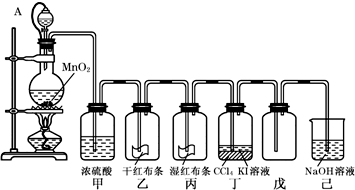
试回答下列问题:
(1)丙中的现象是 ,丁中的现象是 ;
(2)连接橡皮管的目的是 ;
(3)烧瓶内发生反应的离子方程式为 ;烧杯中发生反应的离子方程式 ;
(4)若将氯气和另一种具有漂白作用的气体SO2按体积比1:1混合通入品红溶液,品红溶液未褪色,其原因是 .(用离子方程式表达)
(1)本实验用到的仪器已有药匙、烧杯、量筒、托盘天平(砝码、镊子)、玻璃棒、胶头滴管,还缺少的玻璃仪器是
(2)配制时,需称取NaCl的质量是
(3)在配制过程中,其它操作都正确的情况下,下列操作会导致所配制的溶液浓度偏高的是
①没有洗涤烧杯和玻璃棒 ②定容时俯视标线 ③容量瓶不干燥,含有少量蒸馏水
Ⅱ.为了讲授“氯气的性质和用途”,老师用二氧化锰和浓盐酸制取氯气,并设计了如图所示装置(其中A是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)进行了教学.

试回答下列问题:
(1)丙中的现象是
(2)连接橡皮管的目的是
(3)烧瓶内发生反应的离子方程式为
(4)若将氯气和另一种具有漂白作用的气体SO2按体积比1:1混合通入品红溶液,品红溶液未褪色,其原因是
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:Ⅰ.(1)根据配制一定物质的量浓度的溶液的步骤选择使用的仪器,并判断还缺少的仪器;
(2)依据n=C×V,m=n×M计算氯化钠的质量;
(3)依据C=
分析,凡是能够使n减小或者V增大的操作都会使溶液的浓度偏小,反之,溶液的浓度偏大;
Ⅱ.(1)氯气与水反应生成次氯酸,次氯酸具有漂白性,氯气的氧化性强于碘,碘易溶于四氯化碳;
(2)橡皮管可以使分液漏斗与烧瓶内压强相等,有利于液体流下;
(3)二氧化锰与浓盐酸反应生成氯化锰、氯气和水;氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)氯气具有强的氧化性,能够氧化二氧化硫.
(2)依据n=C×V,m=n×M计算氯化钠的质量;
(3)依据C=
| n |
| V |
Ⅱ.(1)氯气与水反应生成次氯酸,次氯酸具有漂白性,氯气的氧化性强于碘,碘易溶于四氯化碳;
(2)橡皮管可以使分液漏斗与烧瓶内压强相等,有利于液体流下;
(3)二氧化锰与浓盐酸反应生成氯化锰、氯气和水;氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)氯气具有强的氧化性,能够氧化二氧化硫.
解答:
解:I.(1)配制500mL 0.2mol/L NaCl溶液的步骤为:计算、量取、稀释、转移、洗涤、定容、摇匀等,需要使用的仪器有:量筒、烧杯、100mL容量瓶、胶头滴管、玻璃棒等,所以还缺少的仪器为:500 mL容量瓶;
故答案为:500 mL容量瓶;
(2)配制500mL 0.2mol/L NaCl溶液,需要氯化钠的物质的量n=0.5L×0.2mol/L=0.1mol,质量m=0.1mol×58.5g/mol≈5.9g;
故答案为:5.9;
(3)①没有洗涤烧杯和玻璃棒,溶质的物质的量n偏小,溶液的浓度偏小,故①错误;
②定容时俯视标线,导致溶液的体积V偏小,溶液的浓度偏大,故②正确;
③容量瓶不干燥,含有少量蒸馏水,多n和V都不会产生影响,故③错误;
故选:②;
II.(1)氯气与水反应生成次氯酸,次氯酸具有漂白性,所以丙中湿润的红布条褪色;氯气的氧化性强于碘,碘易溶于四氯化碳,所以丁中发生萃取,现象:下层CCl4层呈紫红色;
故答案为:湿润的红布条褪色;下层CCl4层呈紫红色;
(2)橡皮管可以使分液漏斗与烧瓶内压强相等,有利于液体流下,故答案为:有利于分液漏斗中的浓盐酸顺利流下;
(3)二氧化锰与浓盐酸反应的离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
氯气与氢氧化钠溶液反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O;
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;Cl2+2OH-═Cl-+ClO-+H2O;
(4)氯气与二氧化硫反应的离子方程式为:SO2+Cl2+2H2O═SO42-+2Cl-+4H+,故答案为:SO2+Cl2+2H2O═SO42-+2Cl-+4H+.
故答案为:500 mL容量瓶;
(2)配制500mL 0.2mol/L NaCl溶液,需要氯化钠的物质的量n=0.5L×0.2mol/L=0.1mol,质量m=0.1mol×58.5g/mol≈5.9g;
故答案为:5.9;
(3)①没有洗涤烧杯和玻璃棒,溶质的物质的量n偏小,溶液的浓度偏小,故①错误;
②定容时俯视标线,导致溶液的体积V偏小,溶液的浓度偏大,故②正确;
③容量瓶不干燥,含有少量蒸馏水,多n和V都不会产生影响,故③错误;
故选:②;
II.(1)氯气与水反应生成次氯酸,次氯酸具有漂白性,所以丙中湿润的红布条褪色;氯气的氧化性强于碘,碘易溶于四氯化碳,所以丁中发生萃取,现象:下层CCl4层呈紫红色;
故答案为:湿润的红布条褪色;下层CCl4层呈紫红色;
(2)橡皮管可以使分液漏斗与烧瓶内压强相等,有利于液体流下,故答案为:有利于分液漏斗中的浓盐酸顺利流下;
(3)二氧化锰与浓盐酸反应的离子方程式为:MnO2+4H++2Cl-
| ||
氯气与氢氧化钠溶液反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O;
故答案为:MnO2+4H++2Cl-
| ||
(4)氯气与二氧化硫反应的离子方程式为:SO2+Cl2+2H2O═SO42-+2Cl-+4H+,故答案为:SO2+Cl2+2H2O═SO42-+2Cl-+4H+.
点评:本题考查了配制一定物质的量浓度溶液,氯气的实验室制备和性质的检验,题目难度不大,明确反应的原理是解题关键,注意离子方程式书写的方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 (1)把6mol A气体和5mol B气体混合放入4L密闭容器中,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),经5min达到平衡,此时生成2mol C,测得D的平均反应速率为0.15mol/(L?min),则
(1)把6mol A气体和5mol B气体混合放入4L密闭容器中,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),经5min达到平衡,此时生成2mol C,测得D的平均反应速率为0.15mol/(L?min),则