题目内容
(1)写出下列物质在水溶液中的电离方程式:氯化铜 硫酸铁
(2)下列物质:①Na ②H2O ③酒精 ④CO2 ⑤NH3 ⑥Cu(OH)2⑦Ba(OH)2 ⑧冰醋酸(纯净的醋酸) ⑨蔗糖 ⑩NaCl溶液?BaSO4.属于电解质的是 ,属于非电解质的是 .(填序号)
(3)已知浓度为0.01mol?L-1的HCl溶液VmL,加水稀释到2VmL,取出10mL,则这10mL溶液中c(H+) mol/L.
(2)下列物质:①Na ②H2O ③酒精 ④CO2 ⑤NH3 ⑥Cu(OH)2⑦Ba(OH)2 ⑧冰醋酸(纯净的醋酸) ⑨蔗糖 ⑩NaCl溶液?BaSO4.属于电解质的是
(3)已知浓度为0.01mol?L-1的HCl溶液VmL,加水稀释到2VmL,取出10mL,则这10mL溶液中c(H+)
考点:电离方程式的书写,电解质与非电解质
专题:离子反应专题
分析:(1)氯化铜是强电解质完全电离,硫酸铁是强电解质完全电离;
(2)在水溶液或者熔融状态下能够导电的化合物是电解质;在水溶液和熔融状态下都不能导电的化合物是非电解质;
(3)依据稀释前后溶质的物质的量不变,溶液具有均一性,与体积无关.
(2)在水溶液或者熔融状态下能够导电的化合物是电解质;在水溶液和熔融状态下都不能导电的化合物是非电解质;
(3)依据稀释前后溶质的物质的量不变,溶液具有均一性,与体积无关.
解答:
解:(1)氯化铜是强电解质完全电离,电离方程式为:CuCl2=Cu2++2Cl-;
硫酸铁是强电解质完全电离,电离方程式为:Fe2(SO4)3=2Fe3++3SO42-;
故答案为:CuCl2=Cu2++2Cl-;Fe2(SO4)3=2Fe3++3SO42-;
(2)⑥Cu(OH)2⑦Ba(OH)2 ⑧冰醋酸(纯净的醋酸)?BaSO4都是化合物,在水溶液或者熔融状态下能够导电,属于电解质;
③酒精 ④CO2 ⑤NH3 ⑨蔗糖都是化合物,在水溶液和熔融状态下本身都不电离而导电,属于非电解质;
故答案为:⑥⑦⑧?; ③④⑤⑨;
(3)溶液稀释前后所含溶质的物质的量不变,设稀释后溶液的浓度为C,则:0.01mol?L-1×V=C×2V,解得C=0.005mol/L,溶液具有均一性,与体积无关,所以取10ml后溶液的浓度仍然是0.005mol/L;
故答案为:0.005mol/L.
硫酸铁是强电解质完全电离,电离方程式为:Fe2(SO4)3=2Fe3++3SO42-;
故答案为:CuCl2=Cu2++2Cl-;Fe2(SO4)3=2Fe3++3SO42-;
(2)⑥Cu(OH)2⑦Ba(OH)2 ⑧冰醋酸(纯净的醋酸)?BaSO4都是化合物,在水溶液或者熔融状态下能够导电,属于电解质;
③酒精 ④CO2 ⑤NH3 ⑨蔗糖都是化合物,在水溶液和熔融状态下本身都不电离而导电,属于非电解质;
故答案为:⑥⑦⑧?; ③④⑤⑨;
(3)溶液稀释前后所含溶质的物质的量不变,设稀释后溶液的浓度为C,则:0.01mol?L-1×V=C×2V,解得C=0.005mol/L,溶液具有均一性,与体积无关,所以取10ml后溶液的浓度仍然是0.005mol/L;
故答案为:0.005mol/L.
点评:本题考查了电解质的判断及电离方程式书写、溶液的稀释,题目钠浓度不大,明确电解质的概念、电离方程式的书写方法是解题关键,注意溶液稀释规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
同周期主族元素性质递变规律( )
| A、原子半径减小 |
| B、电离能增大 |
| C、电负性增大 |
| D、均是周期性增大 |
已知:①5Cl2+I2+6H2O═2HIO3+10HCl ②ClO3-+5Cl-+6H+═3Cl2↑+3H2O下列按物质氧化性顺序由强到弱排列正确的是( )
| A、Cl2>ClO3->IO3- |
| B、ClO3->Cl2>IO3- |
| C、ClO3->IO3->Cl2 |
| D、Cl2>ClO3->IO3- |
下列说法正确的是( )
| A、1 mol氧 |
| B、SO42-的摩尔质量是96 g |
| C、3 mol小麦 |
| D、标准状况下,1 mol O2 |
下列装置或操作能达到目的是( )
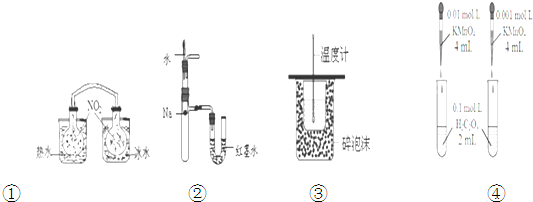

| A、装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)?N2O4(g)平衡移动的方向 |
| B、装置②依据U管两边液面的高低判断Na和水反应的热效应 |
| C、装置③测定中和热 |
| D、装置④依据褪色快慢比较浓度对反应速率的影响 |


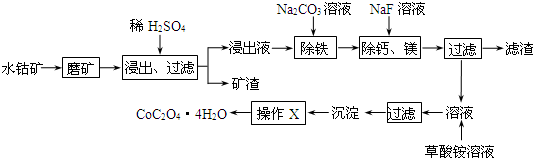
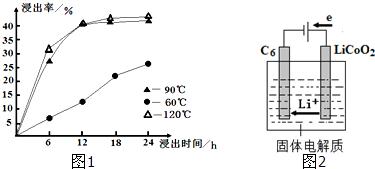
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.