题目内容
将1.35g铝投入50mL25%的硫酸(密度为1.178g/cm3)中.使其完全溶解,将所得溶液稀释至250mL,试计算:
(1)氢离子的浓度;
(2)铝离子的浓度;
(3)取25mL稀释后的溶液,用0.5mol/L氨水中和,并使其中的Al3+离子完全转化为Al(OH)3沉淀,需要此氨水多少毫升?
(1)氢离子的浓度;
(2)铝离子的浓度;
(3)取25mL稀释后的溶液,用0.5mol/L氨水中和,并使其中的Al3+离子完全转化为Al(OH)3沉淀,需要此氨水多少毫升?
考点:化学方程式的有关计算
专题:
分析:25%硫酸的物质的量浓度C(H2SO4)=
=
mol/L=3.0mol/L,n(Al)=
=0.05mol,n(H2SO4)=3.0mol/L×0.05L=0.15mol,n(Al):n(H2SO4)=0.05mol:0.15mol=
<
,所以Al完全溶解,
(1)稀释前后,溶液中溶质的物质的量不变,据此计算稀释后c(H2SO4),再根据原子守恒计算c(H+);
(2)因为Al完全溶解,根据原子守恒计算c(Al3+);
(3)先计算25mL溶液中铝离子的物质的量,再根据一水合氨和铝离子的关系式计算氨水体积.
| 103ρω |
| M |
| 1000×1.178×25% |
| 98 |
| 1.35g |
| 27g/mol |
| 1 |
| 3 |
| 2 |
| 3 |
(1)稀释前后,溶液中溶质的物质的量不变,据此计算稀释后c(H2SO4),再根据原子守恒计算c(H+);
(2)因为Al完全溶解,根据原子守恒计算c(Al3+);
(3)先计算25mL溶液中铝离子的物质的量,再根据一水合氨和铝离子的关系式计算氨水体积.
解答:
解:25%硫酸的物质的量浓度C(H2SO4)=
=
mol/L=3.0mol/L,n(Al)=
=0.05mol,n(H2SO4)=3.0mol/L×0.05L=0.15mol,n(Al):n(H2SO4)=0.05mol:0.15mol=
<
,所以Al完全溶解,
(1)因为Al完全溶解,设消耗硫酸的物质的量为x,
2Al+3H2SO4=Al2(SO4)3+3H2↑
2mol 3mol
0.05molx
2mol:3mol=0.05mol:x
x=
=0.075mol,
则剩余n(H2SO4)=0.15mol-0.075mol=0.075mol,
溶液稀释前后硫酸的物质的量不变,设稀释后硫酸的物质的量浓度为ymol/L,
0.25L×ymol/L=0.075mol,y=0.3,
所以稀释后硫酸浓度为0.3mol/L,
c(H+)=2c(H2SO4)=0.6mol/L,
答:氢离子浓度为0.6mol/L;
(2)因为Al完全反应,根据原子守恒得n(Al)=n(Al3+)=0.05mol,c(Al3+)=
=0.2mol/L,
答:铝离子浓度为0.2mol/L;
(3)25mL溶液体积是250mL溶液的
,则该溶液中铝离子的物质的量应该是250mL溶液中的
,为0.005mol,设消耗氨水体积为VL,
Al3++3NH3.H2O=Al(OH)3↓+3NH4+
1mol 3mol
0.005mol 0.5Vmol
1mol:3mol=0.005mol:0.5Vmol
V=
=0.03,
所以溶液体积为30mL,
答:消耗氨水体积为30mL.
| 103ρω |
| M |
| 1000×1.178×25% |
| 98 |
| 1.35g |
| 27g/mol |
| 1 |
| 3 |
| 2 |
| 3 |
(1)因为Al完全溶解,设消耗硫酸的物质的量为x,
2Al+3H2SO4=Al2(SO4)3+3H2↑
2mol 3mol
0.05molx
2mol:3mol=0.05mol:x
x=
| 3mol×0.05mol |
| 2mol |
则剩余n(H2SO4)=0.15mol-0.075mol=0.075mol,
溶液稀释前后硫酸的物质的量不变,设稀释后硫酸的物质的量浓度为ymol/L,
0.25L×ymol/L=0.075mol,y=0.3,
所以稀释后硫酸浓度为0.3mol/L,
c(H+)=2c(H2SO4)=0.6mol/L,
答:氢离子浓度为0.6mol/L;
(2)因为Al完全反应,根据原子守恒得n(Al)=n(Al3+)=0.05mol,c(Al3+)=
| 0.05mol |
| 0.25L |
=0.2mol/L,
答:铝离子浓度为0.2mol/L;
(3)25mL溶液体积是250mL溶液的
| 1 |
| 10 |
| 1 |
| 10 |
Al3++3NH3.H2O=Al(OH)3↓+3NH4+
1mol 3mol
0.005mol 0.5Vmol
1mol:3mol=0.005mol:0.5Vmol
V=
| 3mol×0.005mol |
| 1mol×0.5mol |
所以溶液体积为30mL,
答:消耗氨水体积为30mL.
点评:本题考查根据方程式的计算,侧重考查学生分析问题、计算能力,注意进行过量计算,根据物质的量不变、原子是进行有关计算,题目难度不大.

练习册系列答案
相关题目
把一定物质的量的金属钠投入到mg足量水中充分反应后得到ag溶液,把与钠物质的量相等的金属镁投入到mg足量盐酸中充分反应后得到bg溶液,则a、b的关系是( )
| A、a>b | B、a<b |
| C、a=b | D、无法确定 |
下列叙述正确的是( )
| A、直径介于1~10nm之间的微粒称为胶体 |
| B、NaOH溶液中滴加FeCl3溶液制得Fe(OH)3胶体 |
| C、利用丁达尔效应可以区别溶液与胶体 |
| D、过滤可以分离胶体粒子与溶液中的溶质粒子 |
进行化学实验必须注意安全,下列说法不正确的是( )
| A、不慎将酸溅到眼中,应立即用大量水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,应立即用大量的水冲洗 |
| C、加热试管或烧杯时,应首先擦干外壁上的水 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
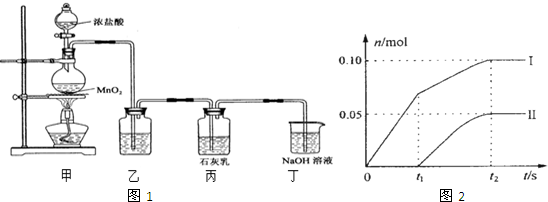
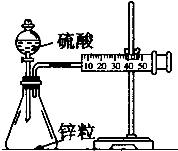 I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验: