题目内容
6.我国晋代炼丹家、医学家葛洪所著《抱扑子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”,其中丹砂是红色的硫化汞.下列说法正确的是( )| A. | 汞可与稀硫酸反应生成氢气 | |
| B. | 丹砂在空气中灼烧发生了分解反应 | |
| C. | 水银在空气中继续加热又生成硫化汞 | |
| D. | 水银温度计打碎时,立即用纸槽收集洒落的汞珠即可 |
分析 A.Hg在金属活泼性顺序表中排在H的后面;
B.丹砂是红色的硫化汞,在空气中灼烧生成HgO、二氧化硫;
C.水银在空气中继续加热与氧气反应;
D.Hg有毒,需收集,或利用硫磺处理可发生Hg+S=HgS,将有毒物质转化为无毒物质.
解答 解:A.Hg在金属活泼性顺序表中排在H的后面,则汞不与稀硫酸反应生成氢气,故A错误;
B.丹砂是红色的硫化汞,在空气中灼烧生成HgO、二氧化硫,不是分解反应液,故B错误;
C.水银在空气中继续加热与氧气反应生成HgO,故C错误;
D.Hg为有毒物质,则水银温度计打碎时,立即用纸槽收集洒落的汞珠即可,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握金属的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意Hg有毒及实验安全处理,题目难度不大.

练习册系列答案
相关题目
16.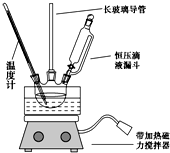 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.
制备硝基苯的过程如下:
①组装如图反应装置.配制混酸,取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混酸,加入漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀.
③在50~60℃下发生反应,直至反应结束.
③除去混酸后,粗产品依次用蒸馏水和10% Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1)
 HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$
HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$ +H2O
+H2O
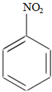 +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$ +
+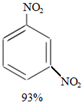 +
+
(2)可能用到的有关数据列表如下
请回答下列问题:
(1)配制混酸应在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应结束后,分离混酸和产品的操作方法为分液.
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)为了得到更纯净的硝基苯,还需先向液体中加入CaCl2(填化学式)除去水,然后采取的实验操作是蒸馏.
 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.制备硝基苯的过程如下:
①组装如图反应装置.配制混酸,取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混酸,加入漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀.
③在50~60℃下发生反应,直至反应结束.
③除去混酸后,粗产品依次用蒸馏水和10% Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1)
 HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$
HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$ +H2O
+H2O +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$ +
+ +
+
(2)可能用到的有关数据列表如下
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃) | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸[来] | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
(1)配制混酸应在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应结束后,分离混酸和产品的操作方法为分液.
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)为了得到更纯净的硝基苯,还需先向液体中加入CaCl2(填化学式)除去水,然后采取的实验操作是蒸馏.
17.X、Y、Z、W是原子序数依次增大的四种短周期元素,已知X、Z,Y、W分别位于同一主族,X与Z形成的离子化合物能与X、Y形成的常见液态共价化合物反应生成X2单质,Y、W两元素可形成两种常见的化合物,以下说法正确的是( )
| A. | X、Y、Z、W四种元素形成的化合物,其水溶液一定显强酸性 | |
| B. | Y、W的氢化物的稳定性后者强于前者 | |
| C. | X、Y、Z、W形成的简单离子半径大小依次增大 | |
| D. | Z的单质可与X、Y形成的共价化合物反应生成X2单质 |
18.下列指定反应的离子方程式正确的是( )
| A. | 向Mg (HCO3)2溶液中,加入过量的澄清石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:NH4++2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 向2mL 1mo1/L Fe(NO3)2溶液中加等体积等物质的量浓度的氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| D. | CuC12溶液中加入H2S溶液:Cu2++S2-═CuS↓ |
15.下列物质中不属于电解质的是( )
| A. | KOH | B. | CuCl2 | C. | H2SO4 | D. | 蔗糖 |
5.铁盐是中学化学常见的盐.下面是以富含硫酸亚铁的工业废液为原料生产氧化铁和制备草酸亚铁晶体(FeC2O3•xH2O )的工艺流程图(部分操作和条件略).

请回答下列问题:
已知:①pH>4时,Fe2+易被氧气氧化;②NH4HCO3在热水中会分解;
③几种物质的溶解度(g/l00g H2O)如下
(1)流程图步骤Ⅰ中,在提纯时需要加足量的铁屑的原因是除去废液中的2Fe3+(或Fe+2Fe3+=3Fe2+).
(2)在生产氧化铁的步骤Ⅲ中,生成FeCO3的离子方程式是Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(3)上述流程图制备草酸亚铁过程中,用稀硫酸调溶液pH至1〜2的目的是防止亚铁离子水解,防止亚铁离子氧化趁热过滤的原因是增大杂质的溶解度(防止低温时杂质析出),影响产品的纯度.
(4)己知煅烧FeCO3的化学方程式是4FeCO3+O2═2Fe2O3+4CO2.现煅烧464.0kg的FeCO3,得到316.8kg产品.若产品中杂质只有FeO.则该产品中Fe2O3的质量是288.0kg.
(5)已知:某温度时,Ksp(FeC2O4)=1.0×10-6.Ksp(CaC2O4)=2.0×10-9,此温度下,FeC2O4若要在CaCl2溶液中开始转化为CaC2O4,则CaCl2的浓度必须不低于2.0×10-6mol•L-1.
(6)草酸(HzC2O4)是一种二元弱酸,广泛分布于动植物体中.已知0.1mol•L-1KHC2O4溶液呈酸性.下列说法正确的是ac(填字母序号)a、0.1mol•L-1KHC2O4溶液中:c(K+)+c(H+)═c(HC2O4-)+2c(C2O42-)+c(OH- )
b.0.1mol•L-1KHC2O4溶液中:c(K+)>c(HC2O4-)>c((H2C2O4)>c(C2O42-)
C.0.1mol/LKHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+)>c(Na+)
d.浓度均为0.lmol•L-1KHC2O4和K2C2O4的混合溶液中:2c(K+)═c(HC2O4-)+c(C2O42-)

请回答下列问题:
已知:①pH>4时,Fe2+易被氧气氧化;②NH4HCO3在热水中会分解;
③几种物质的溶解度(g/l00g H2O)如下
| FeS04•7H2O | (NH4)2SO4 | FeSO4•(NH4)2SO4•6H2O | |
| 20℃ | 48 | 75 | 37 |
| 60℃ | 101 | 88 | 38 |
(2)在生产氧化铁的步骤Ⅲ中,生成FeCO3的离子方程式是Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(3)上述流程图制备草酸亚铁过程中,用稀硫酸调溶液pH至1〜2的目的是防止亚铁离子水解,防止亚铁离子氧化趁热过滤的原因是增大杂质的溶解度(防止低温时杂质析出),影响产品的纯度.
(4)己知煅烧FeCO3的化学方程式是4FeCO3+O2═2Fe2O3+4CO2.现煅烧464.0kg的FeCO3,得到316.8kg产品.若产品中杂质只有FeO.则该产品中Fe2O3的质量是288.0kg.
(5)已知:某温度时,Ksp(FeC2O4)=1.0×10-6.Ksp(CaC2O4)=2.0×10-9,此温度下,FeC2O4若要在CaCl2溶液中开始转化为CaC2O4,则CaCl2的浓度必须不低于2.0×10-6mol•L-1.
(6)草酸(HzC2O4)是一种二元弱酸,广泛分布于动植物体中.已知0.1mol•L-1KHC2O4溶液呈酸性.下列说法正确的是ac(填字母序号)a、0.1mol•L-1KHC2O4溶液中:c(K+)+c(H+)═c(HC2O4-)+2c(C2O42-)+c(OH- )
b.0.1mol•L-1KHC2O4溶液中:c(K+)>c(HC2O4-)>c((H2C2O4)>c(C2O42-)
C.0.1mol/LKHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+)>c(Na+)
d.浓度均为0.lmol•L-1KHC2O4和K2C2O4的混合溶液中:2c(K+)═c(HC2O4-)+c(C2O42-)
 .
.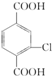 +4NaOH→
+4NaOH→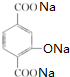 +NaCl+3H2O.②E→F
+NaCl+3H2O.②E→F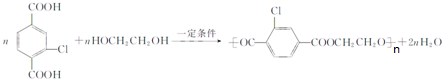 .
.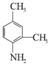 和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.
和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.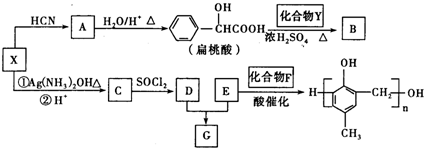
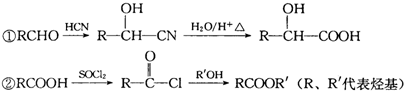
 .
.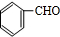 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$ +
+ .
.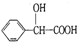 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有3种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式 .
.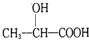 )的路线(其它试剂任选).
)的路线(其它试剂任选). B…$→_{反应条件}^{反应试剂}$目标产物)
B…$→_{反应条件}^{反应试剂}$目标产物)