题目内容
6.密闭的真空容器中放入一定量CaO2固体,发生反应2CaO2(s)?2CaO(s)+O2(g)并达到平衡.保持温度不变,缩小容器容积为原来的一半,重新平衡后,下列叙述正确的是( )| A. | 平衡常数减小 | B. | CaO的量减少 | C. | 氧气浓度变大 | D. | CaO2的量不变 |
分析 保持温度不变,缩小容器容积为原来的一半,压强增大,平衡向气体体积减小的方向移动,即向逆反应方向移动,由于温度不变,平衡常数K=c(O2)不变.
解答 解:保持温度不变,缩小容器容积为原来的一半,压强增大,平衡向气体体积减小的方向移动,即向逆反应方向移动,则CaO的量减小,CaO2的量增大,由于温度不变,平衡常数K=c(O2)不变,而平衡时氧气浓度不变,
故选:B.
点评 本题考查化学平衡影响因素、化学平衡常数等,C选项为易错点,学生容易认为体积减小导致气体浓度增大,忽略平衡常数K=c(O2).

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
8.下列实验事实不能用基团间相互作用来解释的是( )
| A. | 与Na反应时,乙醇的反应速率比水慢 | |
| B. | 苯酚能与NaOH溶液反应而乙醇不能 | |
| C. | 乙醇能使重铬酸钾溶液褪色而乙酸不能 | |
| D. | 苯、甲苯发生硝化反应生成一硝基取代产物时,甲苯的反应温度更低 |
9.根据如图转化关系判断下列说法不正确的是( )


| A. | 反应Ⅰ中SO2是还原剂 | B. | 反应Ⅲ中H2是还原产物 | ||
| C. | 氧化性强弱顺序:H2SO4>I2>SO2 | D. | 该转化关系可实现分解H2O制取H2 |
1.下列各组比较不正确的是( )
| A. | 金属性强弱:Na>Mg>Al | B. | 热稳定性:HCl>H2 S>PH3 | ||
| C. | 酸性强弱:HClO4>H2 SO4>H3PO4 | D. | 熔点:Na>SiO2>CO2 |
11.糖类、油脂和蛋白质是维持人体生命活动所必须的三大营养物质,以下叙述正确的是( )
| A. | 淀粉水解的最终产物是葡萄糖 | |
| B. | 植物油不能使溴的四氯化碳溶液褪色 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
18.下列叙述中正确的是( )
| A. | 油脂都不能使溴的四氯化碳溶液褪色 | |
| B. | 乙烯的结构简式可表示为CH2CH2 | |
| C. | 苯、乙醇和乙酸都可以发生取代反应 | |
| D. | 油脂皂化反应基本完成的现象是反应后静置,反应液分两层 |
15.下列实验不能达到实验目的是( )
| A. |  萃取时振荡分液漏斗 | B. |  电解精炼铜 | ||
| C. |  铝热反应 | D. |  实验室模拟合成氨 |
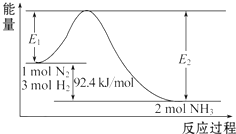 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究. 实验小组为探究SO2的漂白性和还原性,设计了以下实验.
实验小组为探究SO2的漂白性和还原性,设计了以下实验.