题目内容
14. 科学家一直致力于“人工固氮”的方法研究.
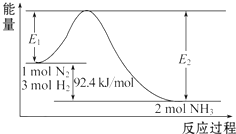
科学家一直致力于“人工固氮”的方法研究.(1)合成氨的原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,该反应的能量变化如图所示.
①在反应体系中加入催化剂,反应速率增大,E2的变化是减小(填“增大”、“减小”或“不变”).
②将0.3mol N2和0.5mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的$\frac{7}{8}$,此时H2的转化率为30%;欲提高该容器中H2的转化率,下列措施可行的是AB(填选项字母).
A.向容器中按原比例再充入原料气
B.向容器中再充入一定量H2
C.改变反应的催化剂
D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1 530kJ/mol
又知:H2O(l)?H2O(g)△H=+44.0kJ/mol
则2N2(g)+6H2O(g)?4NH3(g)+3O2(g)△H=+1266kJ/mol,该反应的化学平衡常数表达式为K=$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{6}({H}_{2}O)}$,控制其他条件不变,增大压强,K值不变(填“增大”、“减小”或“不变”).
分析 (1)①在反应体系中加入催化剂,活化能降低;
②将0.3mol N2和0.5mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的$\frac{7}{8}$,则:
N2(g)+3H2(g)?2NH3(g)
起始(mol):0.3 0.5 0
转化(mol):x 3x 2x
平衡(mol):(0.3-x) (0.5-3x) 2x
相同条件下压强之比等于物质的量之比,结合平衡时压强计算解答;
欲提高转化率可以按原比例向容器中再充入原料气(相当于加压),液化生成物分离出氨,正反应为放热反应,也可以降温;
(2)已知:①2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1 530kJ/mol
②H2O(l)?H2O(g)△H=+44.0kJ/mol
根据盖斯定律,①-②×6可得:2N2(g)+6H2O(g)?4NH3(g)+3O2(g);
化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
化学平衡常数只受温度影响,与压强无关,温度不变,平衡常数不变.
解答 解:(1)①在反应体系中加入催化剂,活化能降低,故E2也减小,故答案为:减小;
②将0.3mol N2和0.5mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的$\frac{7}{8}$,则:
N2(g)+3H2(g)?2NH3(g)
起始(mol):0.3 0.5 0
转化(mol):x 3x 2x
平衡(mol):(0.3-x) (0.5-3x) 2x
根据题意有(0.3-x)mol+(0.5-3x)mol+2x mol=(0.3+0.5)×$\frac{7}{8}$,解得x=0.05,转化的氢气为0.15mol,则H2转化率为$\frac{0.15mol}{0.5mol}$×100%=30%,
A.向容器中按原比例再充入原料气,等效为增大压强,平衡正向移动,氢气转化率增大,故A正确;
B.向容器中再充入一定量H2,氢气转化率减小,故B错误;
C.改变反应的催化剂,影响反应速率,不影响平衡移动,氢气转化率不变,故C错误;
D.液化生成物分离出氨,氨气浓度减小,平衡正向移动,氢气转化率增大,故D正确,
故答案为:30%;AD;
(2)已知:①2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1 530kJ/mol
②H2O(l)?H2O(g)△H=+44.0kJ/mol
根据盖斯定律,①-②×6可得:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),则△H=1 530kJ/mol-6×44kJ/mol=+1266kJ/mol;
2N2(g)+6H2O(g)?4NH3(g)+3O2(g)的化学平衡常数表达式K=$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{6}({H}_{2}O)}$,化学平衡常数只受温度影响,控制其他条件不变,增大压强,K值不变,
故答案为:+1266;$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{6}({H}_{2}O)}$;不变.
点评 本题考查化学平衡计算与影响因素、化学平衡常数、反应热有关计算等,掌握三段式在化学平衡计算中应用,注意平衡常数只受温度影响,其表达式及单位与化学计量数有关.

 阅读快车系列答案
阅读快车系列答案| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | Fe→FeSO4 | B. | NaOH→NaCl | C. | CaO→CaSO4 | D. | CaCO3→CO2 |
| A. | 吸热反应,m+n<p | B. | 吸热反应,m+n>p | C. | 放热反应,m+n<p | D. | 放热反应,m+n>p |

| A. | c为阴极,d为阳极 | B. | 氯离子往d电极移动 | ||
| C. | 该装置能将化学能转化为电能 | D. | d的电极反应式为:Cu2++2e-═Cu |
| A. | 平衡常数减小 | B. | CaO的量减少 | C. | 氧气浓度变大 | D. | CaO2的量不变 |
| A. | 1molCu与足量硫反应生成Cu2S,转移的电子数为2NA | |
| B. | 标准状况下,分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| C. | 常温常压下,1.6gCH4中含有的原子总数为5NA | |
| D. | 常温下,1L0.1mol•L-1的NHCl4溶液中NH4+的数目为0.1NA |
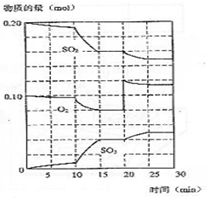 在一定条件下发生如下反应:2SO2(g)+O2 (g)?2SO3(g);△H<0
在一定条件下发生如下反应:2SO2(g)+O2 (g)?2SO3(g);△H<0