题目内容
11.海水提镁的工业流程如下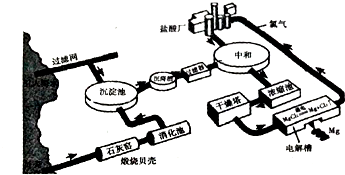
(1)煅烧贝壳时,贝壳的主要成分发生了什么变化?CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑(用化学方程式表示).
(2)从海水中的镁离子到金属镁,主要经历了三步化学变化,写出前两步反应的化学反应方程式:
①MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓;
②Mg(OH)2+2HCl=MgCl2+2H2O.
③第三步反应(MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是2NA.
(3)在生产过程中采用了一些措施提高经济效益,请写出一点利用海滩上的贝壳做原料.
分析 (1)贝壳成分为碳酸钙,依据碳酸钙不稳定受热分解生成二氧化碳、氧化钙书写方程式;
(2)海水中加入贝壳煅烧得到氧化钙溶于水生成的氢氧化钙沉淀镁离子生成氢氧化镁沉淀,过滤得到氢氧化镁沉淀中加入盐酸溶解得到氯化镁溶液,蒸发浓缩,冷却结晶,过滤洗涤得到氯化镁晶体,氯化氢气流中加热失去结晶水得到固体氯化镁固体,电解熔融氯化镁得到金属镁;MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,依据化学方程式电子转移总数计算;
(3)提高经济效益的措施是利用海滩上的贝壳做原料等.
解答 解:(1)贝壳高温煅烧生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)海水中加入贝壳煅烧得到氧化钙溶于水生成的氢氧化钙沉淀镁离子生成氢氧化镁沉淀,反应的化学方程式为:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓,过滤得到氢氧化镁沉淀中加入盐酸溶解得到氯化镁溶液,Mg(OH)2+2HCl=MgCl2+2H2O,蒸发浓缩,冷却结晶,过滤洗涤得到氯化镁晶体,氯化氢气流中加热失去结晶水得到固体氯化镁固体,电解熔融氯化镁得到金属镁,反应的化学方程式为:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
前两步方程式为:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓,Mg(OH)2+2HCl=MgCl2+2H2O;
③MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,依据方程式可知镁元素从+2价降为0价,每生成1molMg电子转移2NA,
故答案为:①MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓
②Mg(OH)2+2HCl=MgCl2+2H2O;
③2NA;
(3)海滩有大量的贝壳,就地取材,用贝壳作原料可以节约成本,提高经济效益;
故答案为:利用海滩上的贝壳做原料.
点评 本题考查了海水提取金属镁的工业流程及其反应原理分析,明确工艺流程及相关物质的性质是解题关键,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 100g质量分数是98%的浓硫酸中所含氧原子数为4NA | |
| B. | 标况下33.6mL氯气通入足量水中发生反应,转移电子数为1.5×10-3NA | |
| C. | 常温常压下,5.6g乙烯与丁烯的混合物中含有的氢原子数目为0.8 NA | |
| D. | 同温下,pH=1体积为1L的硫酸溶液所含氢离子数与pH=13体积为1L的氢氧化钠溶液所含氢氧根离子数均为0.1NA |
| A. |  称量 | B. |  溶解 | C. |  转移 | D. |  定容 |
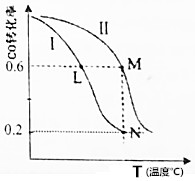
| A. | 该反应的△H>0 | |
| B. | M点化学平衡常数K=0.59 | |
| C. | L、M两点容器内压强:P(M)>2P(L) | |
| D. | 向N点平衡体系中再加入1molCH3OH,建立新平衡时被分解的CH3OH物质的量小于0.4mol |
| A. | 甲烷和苯都能发生取代反应 | |
| B. | 乙醇和乙酸都能与氢氧化钠发生中和反应 | |
| C. | 乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应 | |
| D. | 淀粉、油脂、蛋白质都属于天然高分子化合物 |
| A. | 2:1 | B. | 100:1 | C. | 1:100 | D. | 无法确定 |
 .
.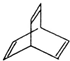 X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有2种.
X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有2种. .Y能使溴水褪色,其反应的化学方程式为
.Y能使溴水褪色,其反应的化学方程式为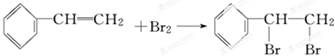 .Y可以用来合成一种聚合物---泡沫塑料,请写出该聚合物的结构简式
.Y可以用来合成一种聚合物---泡沫塑料,请写出该聚合物的结构简式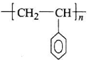 .有机化学中有多种同分异构现象,其中有顺反异构,请写出Y的侧链多一个甲基的有机物W的两种顺反异构的结构简式:
.有机化学中有多种同分异构现象,其中有顺反异构,请写出Y的侧链多一个甲基的有机物W的两种顺反异构的结构简式: ,
,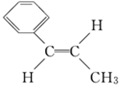 .
.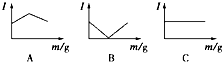 在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.
在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.