题目内容
8.NA表示阿伏加德罗常数,则下列说法正确的是( )| A. | 2.4g Mg变成Mg2+时失去的电子数为0.1 NA | |
| B. | 标准状况下,11.2 L水所含的原子数为1.5 NA | |
| C. | 在常温常压下,32g氧气所含原子数目为2NA | |
| D. | 0.1mol/LK2SO4溶液含有 K+0.2 NA |
分析 A、求出镁的物质的量,然后根据镁反应后变为+2价来分析;
B、标况下水为液体;
C、氧分子由氧原子构成;
D、溶液体积不明确.
解答 解:A、2.4g镁的物质的量为0.1mol,而镁反应后变为+2价,故0.1mol镁失去0.2mol电子即0.2NA个,故A错误;
B、标况下水为液体,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、氧分子由氧原子构成,故32g氧气分子中含有的氧原子的物质的量为n=$\frac{32g}{16g/mol}$=2mol,个数为2NA个,故C正确;
D、溶液体积不明确,故溶液中的钾离子的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
18.今有高聚物
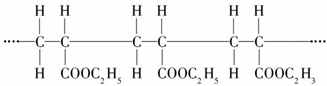
下列对此高聚物的分析中,正确的是( )

下列对此高聚物的分析中,正确的是( )
| A. | 其单体是CH2=CH2和HCOOC2H5 | B. | 这是缩聚反应产物 | ||
| C. | 其链节是CH3CH2-COOC2H5 | D. | 其单体是CH2=CH-COOC2H5 |
16.下列各组物质中,不满足组内任意两种物质在一定条件下(可以配成水溶液)均能发生反应的是( )
| A. | Al203、HCl、NaOH | B. | NH3、O2、HNO3 | ||
| C. | SiO2、NaOH、HF | D. | CO2、Ca(OH)2、Na2CO3 |
3.下列说法中正确的是( )
| A. | 含有氧元素的化合物都是氧化物 | |
| B. | 同种分子构成的物质一定是纯净物 | |
| C. | 非金属氧化物都是酸性氧化物 | |
| D. | BaSO4在水溶液中难导电.所以BaSO4是非电解质 |
20.下列试剂的保存方法正确的是( )
| A. | 少量金属钠保存在乙醇中 | |
| B. | 新制氯水存放在带玻璃塞的无色细口瓶中 | |
| C. | 氢氧化钠固体保存在带橡胶塞的广口瓶中 | |
| D. | 浓硝酸保存在带橡胶塞的无色玻璃瓶中 |
17.某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为1:4:1:2,则M离子可能是下列中的( )
| A. | Na+ | B. | OH- | C. | S2- | D. | Ag+ |
18.某气体在标准状况下的密度为1.696g•L-1,则该气体可能是( )
| A. | CO | B. | N2 | C. | CO2 | D. | F2 |
 .
.