题目内容
7.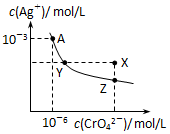 已知T℃时AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,T℃时在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
已知T℃时AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,T℃时在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | T℃时Ag2CrO4的Ksp=2×10-12 | |
| B. | 浓度均为2×10-5mol/LAgNO3溶液与NaCl溶液等体积混合没有沉淀生成 | |
| C. | 在饱和Ag2CrO4溶液中加入K2CrO4固体可使溶液由Y点到X点 | |
| D. | 保持温度T℃不变,Ag2CrO4溶液长时间放置可使溶液由X点到Z点 |
分析 A.Ksp=c2(Ag+)c(CrO42-);
B.Qc>Ksp生成沉淀,Qc<Ksp无沉淀生成;
C.在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上;
D.由X点到Z点,Ag+浓度减小,CrO42-离子浓度不变.
解答 解:A.曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为Ag2CrO4(s)?2Ag+(aq)+CrO42-(aq),则Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,故A错误;
B.浓度均为2×10-5mol/LAgNO3溶液与NaCl溶液等体积混合物,Qc=1×10-5×1×10-5=1×10-10<Ksp,没有沉淀生成,故B正确;
C.在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故C错误;
D.Ag2CrO4溶液长时间放置,溶剂减少,可转化为饱和溶液,(Ag+)、c(CrO42-)均增大,而X点到Z点,Ag+浓度减小,CrO42-离子浓度不变,与图象不符,故D错误;
故选B.
点评 本题考查难溶电解质的溶解平衡及图象,为高频考点,把握Ksp的计算、图象中溶解平衡点为解答的关键,侧重分析与应用能力的考查,选项D为解答的难点,题目难度不大.

练习册系列答案
 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
18.在等温、等容条件下,有下列气体反应:2A(g)+2B(g)?C(g)+3D(g),现分别从两条途径建立平衡:Ⅰ.A、B的起始浓度均为2mol/LⅡ.C、D的起始浓度分别为2mol/L和6mol/L,下列叙述正确的是( )
| A. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| B. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成不同 | |
| C. | 达平衡时,Ⅰ途径的反应速率v1等于Ⅱ途径的反应速率v2 | |
| D. | 达平衡时,Ⅰ途径混合气体的密度与Ⅱ途径混合气体的密度相等 |
15.下列各组微粒具有相同的质子数和电子数的是( )
| A. | OH-、H2O、F- | B. | NH3、NH4+、NH2- | C. | H3O+、NH4+、NH2- | D. | HCl、F2、H2S |
2.将盛有N2和NO2混合气体的试管倒立与水中,经过足够长的时间,试管内的气体体积缩小为原来的三分之二,则混合气体中N2和NO2的体积比是( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
12.下列有关离子化合物、共价化合物的性质描述,不正确的是( )
| A. | 离子化合物都能溶于水,而共价化合物都不溶于水 | |
| B. | 离子化合物的熔点一般较高,而共价化合物的熔点一般较低 | |
| C. | 离子化合物的硬度一般较大,而共价化合物的硬度一般较小 | |
| D. | 离子化合物在熔融条件下能够导电,而共价化合物在熔融条件下不能导电 |
19.下面有关离子晶体的叙述中(氯化钠晶胞如图),不正确的是( )
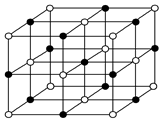

| A. | 1 mol氯化钠中有NA个NaCl分子 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 平均每个NaCl晶胞中有4个Na+、4个Cl- |
16.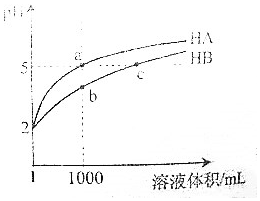 25℃时,pH=2的HA和HB各1mL分别加水稀释,pH随溶液体积变化如图所示.下列叙述正确的是( )
25℃时,pH=2的HA和HB各1mL分别加水稀释,pH随溶液体积变化如图所示.下列叙述正确的是( )
 25℃时,pH=2的HA和HB各1mL分别加水稀释,pH随溶液体积变化如图所示.下列叙述正确的是( )
25℃时,pH=2的HA和HB各1mL分别加水稀释,pH随溶液体积变化如图所示.下列叙述正确的是( )| A. | Kw的数值:a点大于c点 | |
| B. | 溶液中的总酸量:a点大于b点 | |
| C. | HB的电离程度:b点大于c点 | |
| D. | 将a点与b点两溶液同时升高温度,则$\frac{c({A}^{-})}{c({B}^{-})}$减小 |