题目内容
50mL的BaCl2溶液中所含有的Cl-可以被20mL 0.5mol?L-1的AgNO3溶液全部沉淀,则BaCl2溶液中Ba2+的物质的量浓度为( )
| A、1mol?L-1 |
| B、0.8mol?L-1 |
| C、0.2mol?L-1 |
| D、0.1mol?L-1 |
考点:物质的量浓度的相关计算
专题:计算题
分析:发生反应:2AgNO3 +BaCl2═Ba(NO3)2+2AgCl↓,根据n=cV计算AgNO3的物质的量,根据方程式计算BaCl2的物质的量,再根据c=
计算.
| n |
| V |
解答:
解:AgNO3的物质的量=0.02L×0.5mol/L=0.01mol,则:
2AgNO3 +BaCl2═Ba(NO3)2+2AgCl↓
2 1
0.01mol n(BaCl2)
故n(BaCl2)=
=0.005mol,
故c(Ba2+)=c(BaCl2)
=0.1mol/L,
故选D.
2AgNO3 +BaCl2═Ba(NO3)2+2AgCl↓
2 1
0.01mol n(BaCl2)
故n(BaCl2)=
| 0.01mol×1 |
| 2 |
故c(Ba2+)=c(BaCl2)
| 0.005mol |
| 0.05L |
故选D.
点评:本题考查化学方程式计算、物质的量浓度计算,比较基础,侧重对基础知识的巩固.

练习册系列答案
相关题目
在某恒温恒容的密闭容器内发生反应:2A(g)+B(g)?C(g)△H<0.开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是( )
| A、再充入2mol A,平衡正移,A的转化率增大 |
| B、如果升高温度,C的体积分数增大 |
| C、如果增大压强,化学平衡一定向正反应方向移动,B的体积分数减小 |
| D、再充入1mol C,C的物质的量浓度将增大 |
下列过程中,共价键没有被破坏的是( )
| A、NH4Cl加热分解 |
| B、HCl气体溶于水 |
| C、金属钠放入水中 |
| D、碘升华 |
下列化学应用中不涉及氧化还原反应的是( )
| A、工业上由硅的氧化物制备硅单质 |
| B、生活中使用明矾净水,除去水中的悬浮的微小颗粒 |
| C、漂白粉用作疫区的环境消毒 |
| D、过氧化钠用作呼吸面具的供氧剂 |
一定质量的液态化合物XY2与标准状况下的一定质量的O2恰好完全反应,化学方程式为:XY2(l)+3O2(g)
XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则:下列说法不正确的是( )
| ||
| A、在标准状况下反应前O2的体积是672 mL |
| B、化合物XY2的质量有7.6 g |
| C、若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为C和S |
| D、XY2 的物质的量为0.01 mol |
下列条件下能大量共存的离子组是( )
| A、在含有大量Fe3+的溶液中:K+、Na+、Cl-、SCN- |
| B、使酚酞试液变红的溶液:Ca2+、K+、HCO3-、NO3-、NO3- |
| C、某强酸性溶液中:K+、Na+、I-、MnO4- |
| D、在c(H+)=1.0×10-13mol?L-1的溶液中:Na+、NO3-、[Al(OH)4]-、SO32- |
元素周期表中主族元素左上角与右下角元素性质相似,如Be和Al、B和Si、…,则下列说法错误的是( )
| A、1mol Be与NaOH溶液反应可生成1mol H2 |
| B、Be0是两性化合物 |
| C、已知Si熔沸点高则B熔沸点也高 |
| D、Li2CO3和LiOH均易溶于水 |
下列说法正确的是( )
| A、1mol/l的NaCl溶液是指溶液中含有1molNaCl |
| B、从1L0.5mol/l的NaCl溶液中取出100ml,其物质的量浓度为0.05mol/l |
| C、0℃时,1molCl2的体积为22.4L |
| D、1mol/l的CaCl2溶液中,Cl-的物质的量浓度为2mol/l |
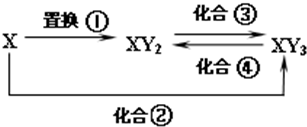 元素X的单质、Y单质及X与Y形成的化合物能按如下图所示的关系发生转化,图中化合反应均为与X或Y单质的反应,且Y单质为气体,
元素X的单质、Y单质及X与Y形成的化合物能按如下图所示的关系发生转化,图中化合反应均为与X或Y单质的反应,且Y单质为气体,