题目内容
氢氰酸(HCN)的下列性质中,不可以证明它是弱电解质的是( )
| A、常温下,0.01mol/L氢氰酸溶液的pH大于2 |
| B、HCN溶液用水稀释后,氢离子浓度下降 |
| C、NaCN溶液呈碱性 |
| D、相同条件下,0.01mol/L氢氰酸溶液的导电性比0.01 mol/L 氯化氢溶液的差 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:氢氰酸为弱电解质,则利用其电离不完全来分析,一般测定溶液的pH或测定相同条件下与强酸的导电性比较来判断.
解答:
解:A.氢氰酸为一元酸,0.01mol/L氢氰酸溶液的pH=2时该酸为强酸,但pH大于2,说明电离生成的氢离子<0.01mol/L,电离不完全,故A不符合;
B.强酸用水稀释后氢离子浓度也下降,故B符合;
C.NaCN溶液呈碱性,可说明NaCN为强碱弱酸盐,水解呈碱性,故C不符合;
D.HCl为一元强酸,在相同条件下,HCN溶液的导电性比盐酸溶液弱,则说明HCN电离不完全,故D不符合;
故选B.
B.强酸用水稀释后氢离子浓度也下降,故B符合;
C.NaCN溶液呈碱性,可说明NaCN为强碱弱酸盐,水解呈碱性,故C不符合;
D.HCl为一元强酸,在相同条件下,HCN溶液的导电性比盐酸溶液弱,则说明HCN电离不完全,故D不符合;
故选B.
点评:本题考查弱电解质的判断方法,明确弱电解质在水中电离不完全是解答本题的关键,学生应注意在平时的学习中归纳判断弱电解质的方法,难度不大.

练习册系列答案
相关题目
某原电池的总反应离子方程为Fe+Cu2+=Fe2++Cu不能实现该反应的原电池是( )
| A、正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| B、正极为C,负极为Fe,电解质溶液为CuSO4溶液 |
| C、正极为Pt,负极为Fe,电解质溶液为CuSO4溶液 |
| D、正极为Ag,负极为Fe,电解质溶液为CuSO4溶液 |
稀氨水中存在下述平衡:NH3+H20?NH3?H2O?NH4++OH-改变下列条件,能使电离程度增大的是( )
| A、加浓氨水 |
| B、升高温度 |
| C、加NH4Cl溶液 |
| D、加NaOH溶液 |
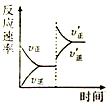 一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)?pC(g)+qD(s),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)?pC(g)+qD(s),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )| A、正反应是放热反应 |
| B、逆反应是放热反应 |
| C、m+n<p+q |
| D、m+n>p+q |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2 |
| B、碱性氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- |
| C、NH4Cl溶液显酸性的原因:NH4++H2O?NH3↑+H2O+H+ |
| D、Na2CO3的水解离子方程式:CO32-+2H2O?H2CO3+2OH- |
下列关于反应2S02(g)+O2(g)?2S03(g)△H<0的说法正确的是( )
| A、升温可以加快合成SO3的速率同时提高SO2的转化率 |
| B、寻找常温下的合适催化剂是未来研究的方向 |
| C、由于△H<0,△S<0,故该反应一定能自发进行 |
| D、当v(O2)生成?2v(SO3)消耗时,说明反应达到平衡状态 |